|
|
||||||||
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Número de elétrons de valência | 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| Valência | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
| Período 2 |
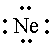 |
|||||||
| Período 3 |
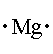 |
 |
||||||
Aula 9
Estrutura de Átomos e Moléculas
- Ligações Químicas
Conhecendo os conceitos básicos da teoria quântica estamos aptos a responder a seguinte questão: Como os átomos são agrupados nas moléculas ? Por exemplo como é a organização atômica nos compostos NaCl e H2O ?
Quando os átomos
estão
fortemente agrupados dizemos existe uma ligação
química
entre eles. Ligações químicas, então,
são
forças intensas que mantêm os átomos juntos. Dentro
do nosso modelo de distribuição eletrônica nos
átomos,
verificamos que os elétrons localizados nas camadas ou
níveis
atômicos internos estão mais fortemente ligados ao
átomo
do que aqueles localizados nas camadas ou níveis mais externos.
Devido a este fato, pode-se mostrar que as ligações
químicas
ocorrem sempre envolvendo os elétrons das camadas mais externas,
as
quais são denominadas de camadas de valências. Isto
significa
que os elétrons pertencentes às camadas mais internas
não
estão, em geral, envolvidos nas ligações
químicas.
Com base nisto, o química americano Gilbert Lewis introduziu uma
simbologia muito conveniente para descrever este fenômeno, a qual
foi denominada de símbolos de Lewis.
Nesta simbologia, de acordo com Lewis, os elétrons da camada de
valência em um átomo são indicados por pontos
colocados
em torno do símbolo atômico, como mostra a tabela 1.
|
|
||||||||
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Número de elétrons de valência | 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| Valência | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
| Período 2 |
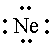 |
|||||||
| Período 3 |
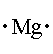 |
 |
||||||
Tab.1 - Símbolos e Valências de alguns elementos
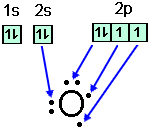
Elétrons de valência no oxigênio
Existe uma relação simples entre o número de elétrons na camada de valência e a valência de cada elemento atômico.
Grupo 1-4 Valência = número de elétrons na camada de valência
Grupo 4-8 Valência = 8 - número de elétrons na camada de valência
Podemos entender esta relação usando a regra do octeto, que será discutida a seguir.
- Regra do Octeto
A valência do neônio e do argônio, os quais têm oito elétrons na camada de valência, é igual a 0. Estes elementos são conhecidos por não formarem qualquer composto e gases mono-atômicos. Isto mostra que a camada de valência com oito elétrons parecer ser uma estrutura eletrônica muito estável. Isto levou a Lewis a sugerir a seguinte regra:
Na formação de compostos um átomo pode ganhar ou perder elétrons ou ainda trocar pares de elétrons de forma a completar oito elétrons na sua camada de valência.
A camada de
valência
contendo oito elétrons é denominada de octeto,
e a regra acima é conhecida como regra
do octeto. Vamos considerar inicialmente o caso onde os
átomos
ganham ou perdem elétrons para obter um octeto.
- Ligações Iônicas
Duas formas óbvias
nas quais um átomo pode obter uma camada de valência com
oito
elétrons são perdendo os seus elétrons externos ou
ganhando elétrons adicionais. Por exemplo, o sódio reage
com o cloro para formar o cloreto de sódio. O sódio tem a
distribuição eletrônica igual a 2, 8, 1 com somente
um elétron na camada de valência. Se o sódio perde
um elétron, será formado um ion positivo de sódio
Na+ com a distribuição eletrônica 2, 8
com
oito elétrons na camada n = 2. Se o cloro, que tem um
distribuição
eletrônica igual a 2, 8, 7 e ganha um elétron então
forma-se um ion ![]() ,
ficando assim com uma distribuição igual a 2, 8, 8. Isto
é o que acontece na prática quando o sódio reage
com
o cloro. Esta reação pode ser resumida numa forma muito
conveniente
usando os símbolos de Lewis:
,
ficando assim com uma distribuição igual a 2, 8, 8. Isto
é o que acontece na prática quando o sódio reage
com
o cloro. Esta reação pode ser resumida numa forma muito
conveniente
usando os símbolos de Lewis:
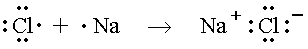
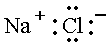 é conhecida como estrutura de Lewis
para o cloreto de sódio.
é conhecida como estrutura de Lewis
para o cloreto de sódio.
Desde que cargas opostas atraem umas as outras, existe uma força de atração entre os ions Na e Cl. O composto NaCl, é sólido (fig.1) com as ligações entre os átomos muito intensa. Este sólido contém proporções iguais de sódio e cloro. A atração eletrostática entre as cargas opostas dos ions é denominada de ligação iônica.
Existem vários compostos que formam ligações iônicas e são por isto denominados de compostos iônicos. Na+Cl- , o Mg2+O2-e Mg2+(Cl- )2 são alguns exemplos de compostos iônicos. Note que tanto o sódio quanto o magnésio são metais e aparecem como íons positivos e os elementos cloro e oxigênio que não são metais aparecem como íons negativos. Em geral podemos estabelecer que;
Elétrons são transferidos dos elementos metálicos para os não metálicos, formando ions metais positivos e ions não metálicos negativos que se agrupam fortemente formando ligações iônicas.
A tabela 2 mostra uma
lista
dos mais comuns íons mono-atômicos, como pode-se ver vista
nesta tabela todos elementos têm oito elétrons na camada
mais
externa, exceto o Li+ e o Be+.
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|||
Tab. 2
Na tabela 3 mostramos algumas fórmulas empíricas e
suas
representações em termos dos símbolos de Lewis.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 |
|
 ) ) |
|
|
|
|
|
|
|
|
|
|
Tab. 3 - Estrutura de Lewis
É importante salientar que o número de átomos envolvidos depende da quantidade de elétrons necessária para a estabilização dos átomos. Por exemplo, na reação do magnésio com o oxigênio, 2 elétrons estão envolvidos, conforme mostrado abaixo.
![]()
No caso de reações entre elementos que envolvem um número diferente de elétrons na sua estabilidade, serão necessárias proporções exatas entre elementos de forma a garantir os elétrons necessários. Por exemplo, dois átomos de sódio são necessários para reagir com um átomo de oxigênio ou 2 de alumínio reagem com 3 de enxofre, conforme esquematizado abaixo:
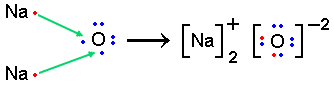
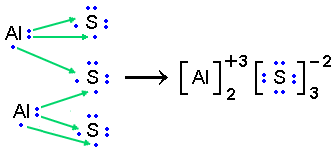
Deve-se notar que, em
todos
os exemplos mostrados, a formação de
ligação
iônica ocorre com um átomo cedendo elétrons ao
outro.
Esta é uma característica da ligação
iônica
envolvendo íons monoatômicos: envolve um elemento com
tendência
a ceder elétrons (eletropositivo) e outro a ganhar
(eletronegativo).
Existem também compostos iônicos formados com íons
poliatômicos. Nestes casos, os íons normalmente são
fragmentos com carga não nula de moléculas covalentes, os
quais serão tratados posteriormente.
- Ligações Covalentes
Vimos anteriormente que quando um metal tal como o magnésio, do qual foi extraído um elétron da camada de valência, combina com um não metal tal como o cloro, o qual tem uma tendência forte de ganhar um elétron adicional, forma-se um composto iônico no qual íons carregado com cargas opostas são agrupados por atração eletrostática. Isto é a base das ligações iônicas. Mas sabemos também que elementos idênticos, tais como o cloro e cloro, podem se agrupar formando compostos do tipos Cl2. Como isto pode ser explicado? Se um cloro ganha um elétron ele se tornaria um íon negativo Cl- , consequentemente o outro perderia um elétron tornando-se um íon positivo Cl+.
Para explicar esta reação, Lewis sugeriu que se cada átomo de cloro compartilhasse com outro um par de elétron, o que promoveria uma reação do tipo,
![]()
Compartilhando um par de elétron ambos os átomos ficam efetivamente com oito elétrons na camada de valência.
Alguns átomos podem fazer várias ligações covalentes compartilhando elétrons com outros átomos, como por exemplo o fósforo com o cloro,
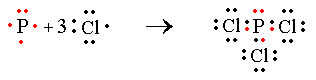 |
|
Os dois diagramas de Lewis acima mostram os arranjos eletrônicos nas moléculas de Cl2 e PCl3.
(a)
(b)
(c)
Fig. 2 -Esta figura mostra três etapas de uma
licação covalente do tiplo dupla
Sempre que dois
átomos
estão ligados usando o compartilhamento de pares de
elétrons,
dizemos que entre eles existe uma ligação covalente. A
molécula
de H2 também é um exemplo de
ligação
covalente mesmo formando um octeto.
As ligações
covalentes têm para cada par de átomo uma distância
de equilíbrio Ro. Para a distância de
equilíbrio
a estrutura molecular está em sua conformação de
menor
energia. Para qualquer outra distância maior ou menor que Ro
a energia de interação entre os átomos é
muito
alta. Veja figura 3.
Fig. 3 Energia de ligação em função
da distância entre os átomos
- Ligações Múltiplas
Quando dois átomos compartilham um par de elétrons a ligação é denominada por ligação simples. Alguns elementos tal como o carbono e oxigênio podem formar ligações duplas, a qual consiste do compartilhamento de dois pares de elétrons, veja esquema de Lewis abaixo,
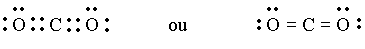
Algumas vezes três pares de elétrons podem ser compartilhados na ligação química entre dois átomos, neste caso dizemos que se formou uma ligação trípla. O carbono e o nitrogênio são tipos de átomos que freqüentemente formam ligações triplas, como por exemplo nas moléculas C2H2 e N2.
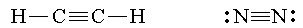
Quando dois pares de
elétrons
são compartilhados entre dois átomos, formando uma
ligação
dupla, a ligação entre eles é mais rígida
do
que uma ligação simples e consequentemente
distância
entre os átomos é menor ligações duplas. A
tabela abaixo mostra os raios das diferentes ligações
covalentes.
|
|
||||||
| Tipo de Ligação |
|
|
|
|
|
|
| Ligação simples |
|
|
|
|
|
|
| Ligação dupla |
|
|
|
|
|
|
| Ligação tripla |
|
|
||||
Tab. 4 - Ligações químicas e seus raios atômicos
- Forças ou Ligações Intermoleculares
Em
condições
ambientais, os compostos iônicos são sólidos,
devido
às forças elétricas de atração
existentes
entre seus cátions e ânions. Do mesmo modo, os metais
são
quase todos sólidos, devido à forte união que a
ligação
metálica exerce sobre seus átomos. Já se
substâncias
covalentes podem ser sólidas, líquidas ou gasosas; isto
prova
que entre suas moléculas podem existir forças de
intensidade
maiores ou menores; exatamente essas forças ou
ligações
entre as moléculas (intermoleculares), que iremos estudar nesta
seção.
- Forças ou ligações dipolo-dipolo
Quando uma molécula é polar como, por exemplo, HCl, ela apresenta uma extremidade mais eletropositiva e outra mais eletronegativa:
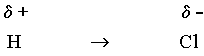
Dizemos, então, que a molécula é um dipolo elétrico permanente, que pode ser representado da seguinte forma:
Fig. 4 - Ligação dipolo-diplo para o H-Cl
Evidentemente o "lado
positivo"
de uma molécula passa a atrair o "lado negativo" da
molécula
vizinha e assim sucessivamente. Essas forças de coesão
recebem
o nome de forças ou ligação de
dipolo-dipolo.
- Pontes de Hidrogênio
Um caso extremo de atração dipolo-dipolo ocorre quando temos o hidrogênio ligado a átomos fortemente eletronegativos, especialmente o fluor, o oxigênio e o nitrogênio. A forte atração que se estabelece entre o hidrogênio e esses elementos chama-se ligaçãode hidrogênio ou ponte de hidrogênio e existe fundamentalmente nos estados sólidos e líquidos.
No esquema abaixo, representamos a estrutura da água no estado líquido, na qual as pontes de hidrogênio estão indicadas por linhas pontilhadas. Por este motivo, alguns químicos sugerem que a água deveria ser representada por (H2O)n , o que indica que um agrupamento de n moléculas de água. As pontes de hidrogênio são suficientemente fortes para alterar as propriedades das substâncias nas quais elas ocorrem, como por exemplo, seus pontos de fusão e de ebulição, e por conseqüência , o estado físico. A figura abaixo mostra uma ponte de hidrogênio entre uma molécula de água e o HCl. Veja que em ambas moléculas existem regiões carregadas positivamente e outras negativamente. Neste caso o hidrogêni formará uma ponte de hidrogênio com o oxigênio da água.
Fig. 5 - Ponte de hidrogênio entre uma molécula de água e o HCl
As
pontes de hidrogênio são extremamente importantes na
formação
e estabilização das hélices a
ou fitas b nas proteínas,
assim
como processo de catálise em zeólitas. A figura (6)
mostra a importância das pontes de hidrogênio na
estabilização
das estruturas proteicas.
Fig. 6 - Veja as pontes de hidrogênio em
cor verde em proteínas

 Electronic
Address :
kcmundim@unb.br
Electronic
Address :
kcmundim@unb.br
Last Updated: Out/22/2000
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura
phone: 55 61 3307 2150