1- Átomos Poli-eletrônico
Na seção anterior, a título de ilustração, vimos a equação de Schrödinger para átomos em geral. A solução desta equação, a qual contém informações completas sobre o comportamento dos átomos e moléculas, fica extremamente complexas quando tratamos átomos ou moléculas com mais de um elétron. Contudo, sob certas aproximações, podemos calcular a função de onda y usando computadores. Hoje, existem várias métodos computacionais numéricos para resolver a equação de Schrödinger no caso de sistemas atômicos ou moleculares com vários elétrons. Estes métodos são classificados em dois grandes grupos; os ab-initios e os semi-empíricos. Os métodos ab-initios resolvem a equação de Schrödinger sem aproximações enquanto os semi-empíricos leva em conta alguns parâmetros obtidos, em geral, de resultados experimentais.
A seguir vamos discutir
algumas
propriedades dos átomos e alguns conceitos básicos que
nos
auxiliarão a compreender o comportamento atômico e
futuramente
o molecular. Lembramos que todas estas propriedades atômicos
podem
ser obtidas via equação de Schrödinger. Assim, todas
as informações aqui discutidas podem ser explicadas
dentro
das teorias da Química moderna ou Química quântica,
mas muitos destes conceitos já eram conhecidos bem antes de se
ter
criado a teoria quântica.
No caso dos átomos
com vários elétrons podemos fazer a seguinte pergunta: Quantos
elétrons podem ser alocados em cada orbital? Se
não
houvesse limitações ao preenchimento dos orbitais
atômicos,
provavelmente teríamos todos os elétrons concentrados no
orbital 1s, já que este é o de menor energia e
consequentemente
não existiram os orbitais 2s, 2p, …. A solução da
equação de Schrödinger, que concorda com os
resultados
experimentais, mostram que apenas dois elétrons podem ocupar o
mesmo
orbital. Assim teremos dois elétrons no orbital 1s, dois no
orbital
2s, e seis nos orbitais do tipo p, isto é px, py
e pz.
É conveniente imaginar, pictoricamente, o orbital como se fosse uma "caixa" onde podemos colocar no máximo dois elétrons. Assim, estando a caixa cheia o terceiro elétron teria que ser colocado em outra caixa ou orbital. Devemos ressaltar que, nesta forma esquemática de representar a distribuição eletrônica, o orbital só existirá se ele estiver preenchido com no mínimo um elétron e no máximo dois.
|
|
Fig. 1 – Representação esquemática para
a ocupação dos orbitais
No sentido de entender o porque da limitação no
número
de elétrons que podem ocupar o mesmo orbital é
necessário
introduzir um quarto número quântico, denominado de spin.
2- O Spin Eletrônico
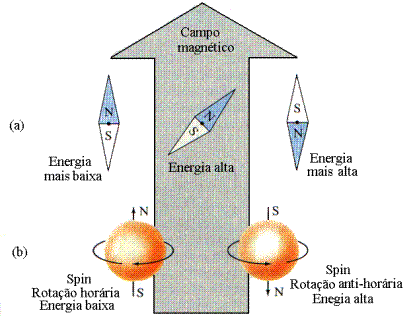
Vários experimentos feitos no início do século XX, mostraram que o elétron tem propriedades magnéticas. Em outras palavras, podemos dizer que quando o elétron é colocado na presença de campo magnético ele se comporta de forma semelhante a uma barra magnética. As propriedades magnéticas do elétron podem ser entendidas, imaginando que ele se comporta como uma carga elétrica girando em torno do seu próprio eixo, como mostra a Fig. 2.
Das equações de Maxwell, no caso do eletromagnetismo, podemos mostrar que cargas em movimento geram campos magnéticos. Nesta sentido, podemos dizer que o elétron se comporta como um imã, já que ele tem movimento de rotação em torno do seu eixo. Sabemos que um imã pode ser orientado quando colocada na presença de campos magnéticos (B) e que a sua energia será mínima quando ele estiver orientado na direção do campo magnético, exatamente como acontece com a agulha das bússolas.
O elétron,
contudo,
difere da agulha da bússola por que ele tem somente duas
orientações
possíveis, quando colocado na presença de campo
magnético
(B). Observa-se, experimentalmente, que quando o elétron
está apontando no mesmo sentido do campo B a energia
é
menor do que quando o seu eixo está apontando no sentido oposto
ao do campo magnético. Com isto, concluímos que a energia
do elétron é quantizada quando ele está na
presença
de um campo magnético. Assim, no caso do elétron no
átomo,
podemos afirmar também que existem somente dois níveis de
energia já que ele pode assumir apenas duas
orientações,
as quais são denominadas por up e down em
inglês.
Isto é, os níveis de energia são discretos ou
quantizados.
Este resultado difere completamente do caso da agulha na bússola
que, como sabemos, ela pode assumir qualquer orientação
em
relação ao campo magnético terrestre. Neste caso
dizemos
que os níveis de energia são contínuos.

O elétron no átomo pode produzir também um outro tipo de campo magnético devido ao seu movimento em torno do núcleo atômico. Para entender este caso, lembramos que objetos massivos em rotação têm momento angular clássico associado o qual é expresso pela equação,
![]()
Consequentemente, estando o elétron se movimentando em torno do núcleo, equivalente ao movimento de uma partícula carregada, podemos então definir o momento magnético orbital (m ) em função do momento angular como a seguir,
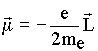
Pela mecânica quântica (resolvendo a equação de Schrödinger) obtém-se a relação de quantização do momento angular, como a seguir
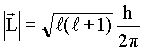
onde ![]() é o
número
quântico azimutal e h é constante de Planck.
é o
número
quântico azimutal e h é constante de Planck.
O vetor momento angular ![]() tem componente ao longo do eixo Z igual a
tem componente ao longo do eixo Z igual a ![]() .
Onde m é o número quântico
magnético.
Assim o momento magnético será igual a,
.
Onde m é o número quântico
magnético.
Assim o momento magnético será igual a,

Esta grandeza representa, então, propriedades magnéticas do elétron devido ao seu movimento em torno do núcleo.
Se o elétron se
encontra
em um estado s (![]() = 0) de acordo com a equação acima ele não deveria
possuir nem momento angular nem momento magnético orbital. No
entanto
a experiência mostra que o elétron possui, assim mesmo um
"momento angular intrínseco"
que é o momento cinético de spin
= 0) de acordo com a equação acima ele não deveria
possuir nem momento angular nem momento magnético orbital. No
entanto
a experiência mostra que o elétron possui, assim mesmo um
"momento angular intrínseco"
que é o momento cinético de spin ![]() cujo
módulo é dado pela relação
cujo
módulo é dado pela relação
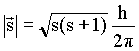 ; ; |
|
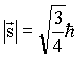 |
cuja componente sz
![]()
Como s = 1/2, temos que
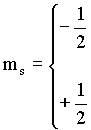 |
|
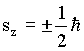 |
ou
|
|
|
|
|
|
|
|
|
Em resumo podemos dizer que os três números
quânticos
(n, ![]() , m
), definidos acima, caracterizam os orbitais atômicos da seguinte
forma:
, m
), definidos acima, caracterizam os orbitais atômicos da seguinte
forma:
a) Níveis
energéticos
Níveis energéticos
são
determinados pelo número quântico
principaln,
os quais no modelo de Bohr-Rutherford correspondem às camadas
eletrônicas
(K, L, M, N, O, P, Q), de acordo com a seqüência abaixo,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b) Subníveis
energéticos
Subníveis
energéticos
são identificados pelo número quântico ![]() ,
que teoricamente pode assumir os valores 0, 1, 2, ... (n-1), onde n
é
o número quântico principal; no entando, para todos os
átomos
conhecidos,
,
que teoricamente pode assumir os valores 0, 1, 2, ... (n-1), onde n
é
o número quântico principal; no entando, para todos os
átomos
conhecidos,![]() não
foge aos valores 0, 1, 2, 3, que
são
habitualmente designidas pelas letras s, p,
d,
f, respectivamente.
não
foge aos valores 0, 1, 2, 3, que
são
habitualmente designidas pelas letras s, p,
d,
f, respectivamente.
|
|
|
|
|
|
|
|
|
|
|
Devemos notar que os subníveis energéticos (e,
portanto,
o número ![]() )
correspondem às linhas finas observadas nas raias dos
espectros
descontínuos dos elementos e correspondem também à
idéia de subcamadas ou órbitas elípticas propostas
por Summerfeld. As próprias letras s, p, d, f, foram tiradas de
expressões usadas na espectroscopia.
)
correspondem às linhas finas observadas nas raias dos
espectros
descontínuos dos elementos e correspondem também à
idéia de subcamadas ou órbitas elípticas propostas
por Summerfeld. As próprias letras s, p, d, f, foram tiradas de
expressões usadas na espectroscopia.
c) Orbitais
Orbitais são
identificados
pelo chamado número quântico magnético m ,
comumente
denominado ml. Num dado subnível, o orbital
central
tem o número quântico magnético igual a zero; os
orbitais
da direita têm m = +1, +2, +3, ... e os da esquerda -1, -2, -3,
...,
como está exemplificado abaixo:
|
|
|
|
|
|
|
|
É importante ressaltar que a idéia dos orbitais está ligada à divisão das linhas finas do espectro em linhas ainda mais finas, sob a influência de um campo magnético extermo forte. Dai a razão do próprio nome, número quântico magnético, dado ao número que identifica o orbital.
d) Spin
Vimos anteriormente que
um feixe de átomos de hidrogênio, ao atravessar, em alta
velocidade
um campo magnético, se divide em dois feixes. Este fato deve-se
ao spin eletrônico ter dois sentidos e com isto se organizarem em
paralelo ou antiparalelo, criando assim campos magnéticos que
serão
repelidos ou atraidos pelo campo magnético externo.
3- Configuração Eletrônica
a) O princípio de exclusão de Pauli
Como mencionamos acima,
é
extremamente conveniente representar o orbital como uma caixa
na
qual podemos colocar setas apontando para cima ou para baixo,
representando
o spin eletrônico. Nesta notação, temos que se
existe
apenas um elétron no orbital ele pode ter tanto
spin up (para
cima
![]() )
quanto down (para baixo
)
quanto down (para baixo
![]() ).
).
|
|
A diferença de energia entre os dois níveis para um elétron na presença de campo magnético é muito pequena. Wolfgang Pauli (1900-1958) foi o primeiro a estabelecer que,
| Um orbital pode acomodar no máximo dois elétrons, tendo eles necessariamente spins opostos. |
Esta afirmação é conhecida como princípio da exclusão de Pauli. Quando um orbital contém dois elétrons de spins opostos ele exclui todos os outros elétrons.
O princípio de Pauli pode também ser enunciado da
seguinte
forma:
| "Se n1, |
Ou então
"Dois elétrons de um átomo não pode ter duas
funções
de onda idênticas."
![]() Exemplo:
Se dois elétrons tem os mesmos números quânticos n,
Exemplo:
Se dois elétrons tem os mesmos números quânticos n, ![]() e m (mesma função de onda espacial como
solução
da equação de Schrödinger) eles diferem pelo
número
ms
(ou função de onda de spin).
e m (mesma função de onda espacial como
solução
da equação de Schrödinger) eles diferem pelo
número
ms
(ou função de onda de spin).
Um orbital é definido pelos três números
quânticos
n, ![]() e m . Nos diagramas de energia é cômodo
representar
o orbital com a ajuda dos "compartimentos quânticos";
e m . Nos diagramas de energia é cômodo
representar
o orbital com a ajuda dos "compartimentos quânticos";
![]() Exemplo:
Exemplo:
|
|
|
Um compartimento quântico pode conter no máximo dois elétrons de spins opostos (ms = +1/2, ms = -1/2)
![]() Exemplo:
Exemplo:
| |
Uma sub-camada, caracteriza pelo número ![]() ,
contém (2
,
contém (2![]() +
1) compartimentos quânticos, ou seja, no máximo 2(2
+
1) compartimentos quânticos, ou seja, no máximo 2(2![]() + 1) elétrons.
+ 1) elétrons.
![]() Exemplo:
Sub-camada d (
Exemplo:
Sub-camada d (![]() = 2) Þ
2x2
+1 = 5 compartimentos quânticos
= 2) Þ
2x2
+1 = 5 compartimentos quânticos
|
|
|
|
|
|
Sub-camada d saturada com 10 elétrons
Uma camada de ordem n encerra n2 compartimentos quânticos
1 + 3 + 5 + 7+…+(2n-1) = n2
e no máximo 2n2 elétrons.
b)- O Princípio da Estabilidade
A estabilidade atômica acontece quando o átomo se encontra no Estado Fundamental, que neste caso, coincide com o estado de mais baixa energia ou estado estável. Isto implica que,
Os elétrons ocupam os níveis de energia mais baixos no limite dos lugares disponíveis
![]() Exemplo:
Hélio (Z = 2) ® orbital 1s
é
o orbital de mais baixa energia
Exemplo:
Hélio (Z = 2) ® orbital 1s
é
o orbital de mais baixa energia
1o elétron ® n
= 1, ![]() = 0, m
= 0, ms = +1/2
= 0, m
= 0, ms = +1/2
2o elétron ® n
= 1, ![]() = 0, m
= 0, ms = -1/2
= 0, m
= 0, ms = -1/2
Spins antiparalelos ® Elétrons emparelhados ou formam um dublete.
Notação abreviada He : 1s2 ( o expoente 2 designando o número de elétrons).
![]() Exemplo:
Lítio (Z = 3)
Exemplo:
Lítio (Z = 3)
| |
|
Ordem de preenchimento: princípios de
Aufbau
ou regra de Klechkowski.
Ordem
n + ![]() crescente
crescente
c) Regras de Hund
Para diversas aplicações, as configurações eletrônicas são suficientes para descrever o arranjo de elétrons em átomos. A energia de um elétron é determinada principalmente pelo nível principal e pelo subnível no qual o elétron está localizado. Porém, algumas vezes, desejamos indicar como os elétrons estão distribuídos no interior dos orbitais. Para isto, utilizamos diagramas orbitais, como os apresentados acima.
Para ilustrar como
são
obtidos diagramas orbitais a partir de configurações
eletrônicas,
considere o átomo de boro (com cinco elétrons). Sua
configuração
eletrônica é 1s2 2s2 2p1
. Sabemos que o par de elétrons no orbital 1s deve ter spins
opostos.
O mesmo é válido para os dois elétrons no orbital
2s. Há três orbitais no subnível 2p. O único
elétron 2p no boro poderia estar em qualquer um destes orbitais.
Seu spin poderia estar "para cima" (ms = + ½) ou "
para
baixo" (ms = - ½). O diagrama de orbital tem a
seguinte
forma,
|
|
|
com o primeiro elétron em um orbital sendo arbitrariamente
representado
por uma seta "para cima"
![]() .
.
Surge uma
complicação
com o próximo elemento, o carbono. Onde
devemos
colocar sexto elétron ? Poderíamos
colocá-lo
no mesmo orbital do outro elétron 2p, e, neste caso, ele teria
que
ter o spin oposto ¯ . Ele poderia
também
ser acomodado em um dos outros dois orbitais, seja com spin paralelo,
ou com spin antiparalelo,
¯ . Resultado
experimentais demonstram que há uma diferença de energia
entre estes arranjos. O arranjo mais estável é aquele no
qual os dois elétrons ocupam orbitais diferentes com spins
paralelos.
O digarama orbital do átomo de carbono é
|
|
|
A situação
acima ocorre freqüentemente com outros átomos. Há um
princípio geral que é aplicável a todos os casos.
Este princípio, conhecido como regra
de
Hund, pode ser assim enunciado:
| Em um dado subnível, a ordem de preenchimento deve permitir que se tenha o maior número possível de orbitais preenchidos com a metade. Os elétrons individuais nestes orbitais metade preenchidos possuem spins paralelos. |
Uma outra forma equivalente de enunciar a regra de Hund é em
termos da regra de máxima multiplicidade de spin. De acordo com
esta regra a distribuição eletrônica nos orbitais
obederão a regra de máxima degenerecência ou
máxima multiplicidade da pela relação M=2S+1, onde
S é o spin total. Por exemplo:
Estado Singleto: Neste caso os elétrons estão spins anti-paralelos, assim S=0 e M=1. Estes sistemas eletrônicos são denominados diamagnéticos:
Estado Tripleto: Neste
caso os dois elétrons ocupam um orbital molecular com spins
paralelos e portanto S=1 e M=3. Estes sistemas são
denominados paramagnéticos.
Seguindo este enunciado
podemos
montar o diagrama de orbitais para todos os outros elementos. Veja
alguns
exemplos na tabela a seguir,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A regra de
Hund,
assim como o princípio da exclusão de Pauli, está
baseada em resultados experimentais. É possível
determinar
o número de elétrons não-emparelhados em um
átomo
qualquer. Com sólidos, isto é feito através de
estudo
do comportamento dos diferentes materiais na presença de campo
magnético.
Havendo a presença de elétrons não-emparelhados, o
sólido será atraído no sentido do campo. Tal substância
é denominada paramagnética. Se os átomos no
sólido
contiverem apenas elétrons emparelhados, ele será
levemente
repelido pelo campo. Substâncias deste tipo são chamadas
diamagnéticas.
Com
átomos
gasosos, o espectro atômico também pode ser usado para
estabelecer
a presença e o número de elétrons
não-emparelhados.
Em particular, observa-se experimentalmente que os átomos H
(gasoso)
e Li (gasoso) são paramagnéticos. Ambos possuem um
único
elétron em um orbital metade preenchido. Por outro lado os
átomos
He (gasoso) e Be (gasoso) são diamagnéticos. Nestes dois
últimos átomos, cada orbital está totalmente
preenchido.
![]() Exemplo:
O átomo de carbono Z = 6 tem a seguinte
configuração
Exemplo:
O átomo de carbono Z = 6 tem a seguinte
configuração
C = 1s2 2s2 2p2
Os dois elétrons da sub-camada 2p têm tendência a
se repelirem e para se afastarem o máximo um do outro é
necessário
que eles ocupem orbitais diferentes. Este fenômeno é
denominado
de correlação de carga.
|
|
|
|
|
|
|
|
|
Arranjos Possíveis
Pode-se mostrar pela
teoria
quântica que dois elétrons em um estado singleto (s
= 0) se deslocam no sentido de ficarem próximos um do outro. Em
conseqüência o estado tripleto favorece o afastamento. Este
efeito que tende a aproximar elétrons de spin antiparalelos e a
afastar os elétrons de spin paralelos é chamado correlação
de spin.
|
|
|
O estado mais estável corresponde a multiplicidade de spin máximo (smax).
smax = Spins paralelos ( mesmo no ms, s = 1 = 1/2 + 1/2), em conseqüência os elétrons devem ocupar orbitais diferentes (Princípio de Exclusão de Pauli).
Conhecendo os números quânticos eletrônico
podemos
agora usar o diagrama de caixas para determinar as
configurações
dos estados eletrônicos fundamentais para os diversos elementos
químicos.
No estado fundamental de qualquer átomo os elétrons
estarão
no orbital de mais baixa energia possível. Então para o
hidrogênio
e o hélio os elétrons estão no orbital 1s:
|
|
|
|
|
||||||||||
|
|
|
|
4 - Essências da Estrutura Atômica
Comentamos em aulas anteriores que existem mais de 100 tipos diferentes de átomos, mas não falamos o quão eles diferem uns dos outros. Para fazer isto necessitamos conhecer a estrutura de cada átomo. Veremos, durante o curso, que todos os átomos são formados pelo mesmo conjunto de partículas básicas. Uma propriedade importante de cada átomo é sua massa. Dalton propôs que todos átomos iguais têm massas iguais e que todos átomos diferentes têm massas diferentes. Veremos, a seguir, que este postulado tem que ser levemente modificado.
Finalmente, estudaremos como usar as massas atômicas para determinar as massas das substâncias, assim como calcular a quantidade de substâncias participantes de uma reação química. Por exemplo, se nós queimamos 1,0 grama de carbono na presença de oxigênio produzimos 3,66 g de dióxido de carbono. Como podemos usar as informações discutidas acima para determinar a fórmula do dióxido de carbono ? Todos os aspectos quantitativos das reações e composições químicas são referidas coletivamente como a estequiometria, que é uma palavra grega significando medida e elemento.
O átomo de hidrogênio é o que tem estrutura mais simples e é o de menor massa. Ele consiste de apenas duas partículas eletricamente carregadas. Uma delas é o próton e a outra o elétron com cargas positiva e negativa respectivamente. A carga do elétron é -1,6022 x 10-19 coulomb (C), e a carga do próton 1,6022 x 10-19 coulomb (C), isto é, são iguais em magnitude. Consequentemente, o hidrogênio é um átomo eletricamente neutro, isto é tem carga total igual a zero.
A massa do átomo de hidrogênio é concentrada praticamente no próton (mp) já que sua massa é mais de mil vezes maior que a massa do elétron (me);
![]()
portanto a razão entre as massas do elétron e do
próton
é igual a me/mp = 1/1836. A carga negativa
do elétron é atraída pela carga positiva do
próton.
De acordo com os modelos
e teorias atuais, sabemos que o elétron gira em torno do
núcleo
atômico formado pelo próton. Sabe-se também que o
elétron
se move em uma órbita "muito bem definida" (no sentido de uma
órbita
quantizada).

O modelo atômico que conhecemos hoje, foi primeiramente proposto por Ernest Rutherford (1871-1937), o qual mostrou que todos os átomos são formados por pequenas partículas negativas (e- elétrons) girando em torno do núcleo positivo (p+ prótons) e que a maior parte da massa atômica está localizada no núcleo atômico. Rutherford e seus colaboradores realizaram várias experimentos para comprovar a suas idéias. A mais importante delas foi o bombardeamento de uma lâmina fina feita de ouro por partículas a (ou átomos de hélio sem os seus elétrons). Usando uma tela fluorescente colocada em torno do aparelho, eles observaram o grau de espalhamento das partículas a (alfa). Observaram também que a maioria das partículas atravessavam a lâmina sem alteração na direção. Algumas delas, entretanto, eram espalhadas mudando assim a direção na sua trajetória. Através de uma análise matemática das forças envolvidas, Rutherford mostrou que o espalhamento era causado por uma carga positiva e de pequeno volume que se situava no centro do átomo de ouro. Estas experiências foram repetidas, usando diferentes elementos. Deste modo, Rutherford e seus colaboradores demonstraram que, em todos os átomos, há um núcleo central denominado de núcleo atômico e que ainda tinha as seguintes características;
![]() - possui uma carga
positiva
de valor igual ao total de cargas negativas (elétrons)
localizados
nas camadas externas ao núcleo,
- possui uma carga
positiva
de valor igual ao total de cargas negativas (elétrons)
localizados
nas camadas externas ao núcleo,
![]() - é
responsável
por mais de 99,9 % da massa total do átomo
- é
responsável
por mais de 99,9 % da massa total do átomo
![]() - possui um
diâmetro
equivalente a apenas 0,01 % do diâmetro do próprio
átomo.
- possui um
diâmetro
equivalente a apenas 0,01 % do diâmetro do próprio
átomo.
Como podemos notar as experiências de Rutherford promoveram uma boa compreensão da estrutura atômica. Para nossos objetivos em química, consideraremos o núcleo como sendo formado por duas partículas diferentes;
![]() - o próton,
que
tem carga positiva e massa praticamente igual a massa do átomo
de
hidrogênio,
- o próton,
que
tem carga positiva e massa praticamente igual a massa do átomo
de
hidrogênio,
![]() - o neutron (n),
que é uma partícula com carga nula e massa praticamente
igual
ao do próton.
- o neutron (n),
que é uma partícula com carga nula e massa praticamente
igual
ao do próton.
|
|
|---|
Vimos acima que, freqüentemente, é bastante conveniente pensar no elétron dentro do átomo não como uma partícula pequena se movendo rapidamente, mas pictoricamente, como uma "nuvem" de carga negativa em torno do núcleo. Esta imagem de átomo poderia ser obtida fazendo uma fotografia do movimento eletrônico por um longo período de tempo. O elétron apareceria não como uma partícula, mas como uma nuvem difusa de carga negativa. Esta nuvem, para o átomo de hidrogênio, teria uma forma esférica, mas com densidade não uniforme. Ela seria mais densa nas proximidades do núcleo e a mais rarefeita a medida que a distância relativa ao núcleo fosse aumentando. Em outras palavras podemos dizer, neste modelo, que o elétron permanece mais tempo nas proximidades do núcleo. Essa nuvem eletrônica é algumas vezes referenciada por densidade eletrônica como mostra as figuras abaixo;
O movimento do elétron em torno do núcleo, deve-se basicamente às forças eletrostáticas. Sabe-se hoje em dia que existem apenas três tipos forças na natureza:
![]() - as forças
gravitacionais que agem em todos os objetos e são
proporcionais
as suas massas,
- as forças
gravitacionais que agem em todos os objetos e são
proporcionais
as suas massas,
![]() - as forças
elétricas que agem entre objetos carregados e
são
proporcionais as suas cargas e
- as forças
elétricas que agem entre objetos carregados e
são
proporcionais as suas cargas e
![]() - as forças
nucleares que agem entre as partículas
sub-atômicas
como os prótons e neutrons.
- as forças
nucleares que agem entre as partículas
sub-atômicas
como os prótons e neutrons.
Em química, apenas as forças elétricas tem destaque. As forças gravitacionais são muito fracas quando comparadas com as forças elétricas, sendo aproximadamente 1039 vezes menor. Já as forças nucleares são importantes somente no caso de distâncias muito pequenas, tal como a distância entre as partículas que formam o núcleo atômico. Estas forças são desprezíveis quando distâncias envolvidas são grandes comparadas com as dimensões dos núcleos atômicos.
A força elétrica entre duas cargas (Q1 e Q2) é descrita pela lei de Coulomb :
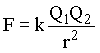
onde r é distância entre as cargas e k é a constante de Coulomb. Da equação acima, podemos notar que se as cargas têm sinais opostos a força é atrativa e se têm mesmo sinal a força é repulsiva.
Robert Millikan foi o primeiro a medir experimentalmente a carga do elétron. Millikan observou microscopicamente gotas de óleo carregadas na presença de duas placas metálicas carregadas. O experimento consistia em ajustar as cargas das placas de forma que a força gravitacional fosse balanceada pela força eletrostática, fazendo com isto que a gota de óleo permanecesse estacionária. Conhecendo as cargas nas placas e usando a lei de Coulomb, Millikan foi capaz de calcular a carga na gota. Repetindo este experimento para diferentes gotas individuais, ele encontrou que a carga na gota era sempre igual a
![]()
ou um múltiplo inteiro deste valor. Em outras palavras, ele
encontrou
que existe uma unidade ou quantidade mínima de carga
elétrica,
indicando que cargas elétricas não contínuas mas
se
apresentam em múltiplos de um quantum de carga. Este quantum de
carga, ou carga mínima é módulo igual a carga do
elétron.
A unidade de carga é o coulomb (C) em homenagem a Coulomb. Em
geral
a carga de uma dada partícula é expressa em termos da
carga
do elétron, isto é múltiplos de e.
Então,
o elétron é dito ter uma carga igual a -1, isto é
uma carga -1e ou -1,60 x 10-19 C. Similarmente o
próton
tem uma carga +1e ou +1,60 x 10-19 C.
5- Número Atômico
Podemos resumir a constituição de núcleo atômico usando dois números :
![]() - O
número
de prótons no núcleo o qual é denominado de número
atômico, representado pelo símbolo Z
- O
número
de prótons no núcleo o qual é denominado de número
atômico, representado pelo símbolo Z
![]() - O
número
total de prótons e neutrons que é denominado de número
de massa
- O
número
total de prótons e neutrons que é denominado de número
de massa
A diferença entre o número de massa e o número atômico é igual ao número de neutrons no núcleo. Por convenção, o número atômico aparece sempre escrito como sub-índice no lado esquerdo do símbolo atômico e o número de massa como índice superior também no lado esquerdo. Como por exemplo :
O ![]() significa
que o átomo de carbono tem número atômico igual a 6
prótons e número de massa igual a 12 (6 prótons +
6 neutrons). No caso geral temos que
significa
que o átomo de carbono tem número atômico igual a 6
prótons e número de massa igual a 12 (6 prótons +
6 neutrons). No caso geral temos que
Como todos os átomos têm carga total nula, isto
é
são eletricamente neutros, é necessário que existe
um número de elétrons tal que anule a carga +Z do
átomo.
Isto significa, por exemplo, que no átomo de carbono existem 6
elétrons
girando em torno do núcleo, produzindo assim uma carga total
igual
a zero. Estas definições leva-nos a concluir que:
|
átomos com os mesmos número atômico (Z). |
6- Isótopos
Um outro aspecto do
núcleo
também deve ser considerado. Afirmamos, anteriormente, que todos
os átomos de um mesmo elemento têm o mesmo número
de
prótons, elétrons e neutrons. Contudo, pode se observar
experimentalmente
que isto nem sempre é verdade. Por exemplo, os átomos de
oxigênio têm número atômico Z = 8 e portanto
têm
8 prótons e 8 elétrons. Mas, foram observados na natureza
três diferentes espécies de átomo de oxigênio
:
|
|
|||||||||||||||
Nos dois exemplos acima, a variação no número de massa deve-se ao aumento do número de neutrons. Os átomos que têm esta característica são denominados isótopos. Todos isótopos de um átomo têm em comum o número atômico Z e consequentemente o mesmo número de elétrons, produzindo assim uma carga total nula. Eles diferem uns dos outros apenas pela massa atômica ou o número de massa.
Observa-se que uma
substância
contendo diferentes isótopos de um elemento têm
propriedades
bastante similares não idênticas.
7- Isóbaros
Isóbaros
são
átomos com o mesmo número de massa (A), mas com
diferentes
números de prótons (elementos diferentes). Eles têm
o mesmo número de prótons e neutrons. Disto
concluímos
que os isóbaros são elementos químicos diferentes,
mas, que possuem a mesma massa, porque o aumento do número de
prótons
é compensado diminuição do número de
neutrons
ou vice-versa. A seguir citamos alguns exemplos de isóbaros:
|
|
|||||||||||||||
Isótonos
são
átomos que possuem a mesma diferença entre o
número
de massa (A) e o número atômico (Z). Eles possuem o mesmo
número de neutrons (n). A seguir citamos um exemplo de
átomos
isótonos.
|
número atômico |
|
|
n = 37 - 17 = 20 |
n = 40 - 20 = 20 |
9 - Massa Atômica e sua Conservação
A massa de um
átomo
é muito pequena para ser expressa em unidades tipo quilogramas
ou
gramas, por que a massa do próton é 1,6726 x 10-27
kg. Existem várias propostas para definir a unidade de massa
atômica.
Hoje em dia a unidade na qual as massas atômicas são
medidas
é definida internacionalmente com sendo 1/12 da massa de um
átomo
de carbono do tipo ![]() .
Esta unidade de massa é chamada unidade
de massa atômica unificada simbolizada por u.
Em
outras palavras, a massa de um átomo de carbono
.
Esta unidade de massa é chamada unidade
de massa atômica unificada simbolizada por u.
Em
outras palavras, a massa de um átomo de carbono ![]() é exatamente igual a 12u.
é exatamente igual a 12u.
A partir das
discussões
acima, somos induzidos a pensar que poderíamos calcular a massa
de um átomo a partir das massas de seus elétrons,
prótons
e neutrons. Mas, na verdade não podemos. Considere, por exemplo,
um átomo de ![]() .
A soma das massas dos seus elétrons, prótons e neutrons
perfazem;
.
A soma das massas dos seus elétrons, prótons e neutrons
perfazem;
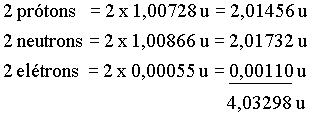
Este total é maior
que a massa do ![]() obtida
experimentalmente, a qual é 4,00260 u. Esta
discrepância
ilustra uma regra e não uma exceção : a massa de
qualquer
átomo é sempre levemente menor do que a soma das massas
dos
elétrons, prótons e neutrons contidos em cada
átomo.
Esta diferença é denominada defeito
de massa. O defeito de massa aparece por que uma grande
quantidade
de energia está envolvida na formação dos
núcleos
atômicos. A quantidade de energia envolvida é tão
grande
que tem uma massa equivalente bastante significante, a qual pode ser
expressa
pela equação :
obtida
experimentalmente, a qual é 4,00260 u. Esta
discrepância
ilustra uma regra e não uma exceção : a massa de
qualquer
átomo é sempre levemente menor do que a soma das massas
dos
elétrons, prótons e neutrons contidos em cada
átomo.
Esta diferença é denominada defeito
de massa. O defeito de massa aparece por que uma grande
quantidade
de energia está envolvida na formação dos
núcleos
atômicos. A quantidade de energia envolvida é tão
grande
que tem uma massa equivalente bastante significante, a qual pode ser
expressa
pela equação :
E = mc2
Onde, E é a energia, m a massa e c a velocidade da luz no vácuo ( 3,00 x 108 m/s). Esta equação foi proposta por Einstein em 1905. Ela correlaciona dois conceitos fundamentais, massa e energia, os quais são usados na descrição do universo.
Percebemos, então, que as reações nucleares estão associadas com uma grande quantidade de energia o que conseqüentemente está acompanhado de uma variação significante na massa. Contrariamente, as reações químicas envolvem apenas uma reorganização dos átomos e a energia necessária para esta reorganização é muito pequena quando comparada as energias nucleares.
A equação que relaciona a massa com a energia, proposta por Einstein, vem fortalecer a lei de conservação da massa :
A massa não pode ser criada e nem destruída.
Esta lei foi formulada inicialmente a mais de dois séculos pelo francês Antoine Lavoisier.
Antoine Lavoisier
Em seus experimentos Lavoisier observou que em diferentes reações químicas não havia variação de massas e entre a substância reagente e os produtos. Assim, podemos estabelecer que em uma dada reação química a massa total é conservada. Em termos da teoria atômica para a lei de conservação da massa segue-se que;
Em uma reação química
os átomos não podem ser criados ou destruídos;
eles são meramente reorganizados
espacialmente.
Uma outra conseqüência destas observações é que;
A energia não pode ser criada ou destruída, mas somente transformada de uma forma em outra.
Estritamente falando, a soma das massas e energias envolvidas nestas transformações permanece constante e em particular, nas reações químicas, a variação na massa é tão pequena que pode ser desprezada.
Tabela Peródica
| 1 |
|
||||||||||||||||||
| 1 | H |
|
|
|
|
|
|
|
|||||||||||
| 2 | Li |
|
|
|
|
|
|
|
|||||||||||
| 3 | Na |
|
3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|
|
|
|
|
|
|
| 4 | K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 | Rb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 6 | Cs |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 7 | Fr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10- O Mol
Um dos usos mais importante da massa atômica é o de encontrar as massas das substâncias reagentes e dos produtos em uma reação química. A massa de uma molécula é a soma das massas de átomos que a compõem, isto é, é igual a soma das massas atômicas na fórmula molecular. Esta massa é chamada de massa molecular. Por exemplo, a fórmula molecular peróxido de hidrogênio (H2O2), entretanto a massa molecular é (2(1,008 u) + 2(16,00 u) que é igual 34,02 u. Tradicionalmente o termo peso molecular tem sido usado como um sinônimo de massa molecular de forma semelhante ao uso do termo peso atômico no lugar de massa atômica.
Nos estudos das reações em um laboratório estamos freqüentemente envolvidos com um número muito grande de átomos de moléculas. Por isto necessitamos de uma forma conveniente de transformar as informações advindas das fórmulas químicas e tabela de massas atômicas em uma unidade de medida prática.
A fórmula de CO
diz-nos
que um átomo de oxigênio combina-se como um átomo
de
carbono para formar a molécula de monóxido de carbono.
|
|
|
|
|
|
| 1 átomo de C + 1 átomo de O | 1 molécula de CO |
| 1 massa atômica de C + 1 massa atômica de O | 1 massa molecular CO |
| 12,01 u C + 16,00 u de O | 28,01 u CO |
|
|
|
|
|
|
| 100 átomos de C + 100 átomos de O | 100 molécula de CO |
| 100 massa atômica de d C + 100 massa atômica de O | 100 massa molecular CO |
| 1201 u C + 1600 u de O | 2801 u CO |
Estes números de átomos ainda é muito pequeno comparado com a quantidade de átomo envolvido em reações químicas em um laboratório. Poderíamos considerar por exemplo as reações envolvendo 6,022 x 1023 átomos de carbono e mesma quantidade de oxigênio para produzir moléculas de CO. Mas, por que estamos escolhendo este número tão grande ? Estamos fazendo isto porque 6,022 x 1023 u é igual a 1,0 grama. Assim,
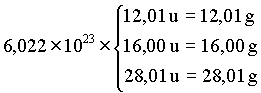
Então para a reação
C + O ® CO
12,01 g de carbono reage com 16,00 g de oxigênio para dar 28,01 g de monóxido de carbono. Em outras palavras, podemos escrever
12,01g de C + 16,00g de O ® 28,01g de CO
Então 6,022 x 1023 é o número de átomos em 12,01 g de carbono, ou o número de átomos em 16,00 g de oxigênio ou o número de moléculas em 28,91 g de monóxido de carbono. Usando a relação
1 g = 6,022 x 1023
podemos expressar a unidade de massa atômica em gramas:
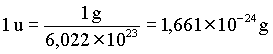
Por esta definição, qualquer quantidade de matéria que contenha 6,022 x 1023 entidades é um mol. Assim, pode-se ter 1 mol de átomos, de moléculas, de íons, de prótons, de elétrons, ou de outras partículas, etc. Havendo tantas possibilidades, a entidade em questão deve ser sempre claramente especificada.
O número 6,022 x 1023
é conhecido por número de Avogadro em homenagem ao
físico italiano Amedeo Avogadro (1776-1856), que fez uma
contribuição muito importante às leis que regulam
o comportamento dos gases. O número de Avogadro, aproximado para
três algarismo estabelece que em 1atg (átomo grama)
de um dado elemento químico existem
6,022 x 1023 átomos
desse elemento. Isto significa que;
| 1 atg de cromo (52,0 g) contém 6,022 x 1023 átomos de cromo |
| 1 atg de alumínio (27,0 g) contém 6,022 x 1023 átomos de alumínio |
|
|
|
![]() Electronic
Address :
kcmundim@unb.br
Electronic
Address :
kcmundim@unb.br
Last Updated: Sep/22/2000
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura
phone: 55 71 237 2033
FAX 55 71 235 5592