![]() 1. Insuficiência da Física Clássica
1. Insuficiência da Física Clássica
A aplicação da Mecânica e da Eletrodinâmica clássica na descrição dos sistemas atômicos e moleculares conduz, rapidamente, a conclusões insustentáveis, em total desacordo com a experiência. Assim, se as leis clássicas se aplicassem a um elétron gravitando em torno de um núcleo positivo, ele deveria irradiar continuamente ondas eletromagnéticas, em conseqüência, perder energia até e finalmente cair (colapsar) sobre o núcleo. Como sabemos, uma tal descrição não se aplica, por exemplo, ao átomo de hidrogênio, o qual é estável e não irradia energia. Da mesma maneira, é absolutamente impossível explicar a existência de moléculas e suas ligações químicas a partir da Física Clássica ou Newtoniana.
A teoria de Bohr para o átomo de hidrogênio (1910) é um exemplo de tentativas na busca da explicação e caracterização dos sistemas atômicos. Entretanto, como todas as teorias foram formuladas segundo os princípios da Física Clássica e sem possibilidade de generalização, elas fracassaram completamente. Seria necessário repensar, então, toda a Física corpuscular.

Niels Bohr (1885-1962)
Foi o trabalho de Louis de Broglie que, em 1924, lançou as bases de uma nova mecânica chamada ondulatória ou quântica (os dois qualificativos são sinônimos neste caso). Completada pelos trabalhos de Heisenberg, Schrödinger, Pauli, Dirac e outros mais, a Mecânica Ondulatória forma, em nossos dias, um conjunto coerente e apropriado ao tratamento de sistemas corpusculares necessitando, entretanto, de uma bagagem matemática considerável.
Em 1924, Louis de Broglie, lembrando-se da natureza dualística dos fótons (sugerida por Einstein ao estudar o efeito fotoelétrico), e considerando que todos os fenômenos naturais envolviam certa forma de matéria e de radiação (ondas eletromagnéticas), sugeriu que, assim como "as ondas de luz" tinham propriedades de partículas, o inverso também deveria ser válido, isto é: " A toda partícula com momento p estaria associada uma onda de comprimento l", isto é : l= h/p, onde h é a constante de Planck e p, o momento linear da partícula. Esta relação implicaria que todos os corpos massivos ou partículas, tais como uma bola de bilhar e um elétron, teriam também propriedades de ondas, cujas características seriam regidas pela mesma teoria das radiações.
Com base nesta hipótese, de Broglie conseguiu deduzir a condição de quantização (de Bohr) do movimento angular aplicando condições de contorno adequadas às ondas de matéria do átomo de hidrogênio.

L. de Broglie (1892-1977)
que é a condição de quantização de L, de acordo com Bohr.
Vimos anteriormente que,
durante o período de 1924 a 1928, as idéias de Einstein,
de Broglie, Bohr, Heisenberg e outros levaram ao desenvolvimento
de uma nova teoria que poderia descrever o comportamento de elétrons
em átomos e moléculas. Esta teoria é denominada de
mecânica
quântica. A teoria quântica deu seus primeiros
passos com a proposta de Max Planck, em 1900, para explicar as propriedades
da radiação do corpo negro. Alguns anos mais tarde, em 1905,
ela foi usada por Albert Einstein ao descrever as emissões de
elétrons por metais expostos à luz o que ficou denominado
por efeito fotoelétrico. Um pouco mais tarde, em 1913, Niels Bohr
usou a teoria quântica para desenvolver um modelo matemático
para o átomo de hidrogênio. Agora sabemos, que a teoria quântica
é uma teoria geral que é aplicável a todas as interações
da matéria com energia. A teoria quântica, no caso de elétrons,
átomos e moléculas se fundamenta nos seguintes postulados:
Em resumo, podemos dizer que
apenas certos valores de energia eletrônica são permitidos
em um átomo. A energia de sistemas que podem apenas existir em estados
discretos é chamada de quantizada. Como a energia eletrônica
de um átomo é quantizada, uma alteração no
nível ou estado eletrônico de um átomo envolve a absorção
ou emissão de uma quantidade definida ou quantum de energia.
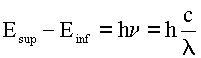
Nesta equação,
Esup é a energia do estado superior ou de maior energia
e Einf é a energia do estado inferior ou de menor energia.
Os símbolos h, c, le
n
são respectivamente a constante de Planck, a velocidade da luz,
o comprimento de onda e a freqüência da radiação
(fóton) absorvida.
![]() 3-
Princípio da Incerteza de Heisenberg
3-
Princípio da Incerteza de Heisenberg
Alguns físicos acreditam que apenas as grandezas suscetíveis de medida têm significado real em Física. Somente se se conseguisse focalizar um super microscópio em um elétron, no interior de um átomo, e se pudesse "vê-lo" percorrendo a sua órbita, seria lícito declarar que esta órbita teria significado. Entretanto, vai-se mostrar agora que é fundamentalmente impossível fazer uma observação desse tipo, mesmo com qualquer instrumento ideal que se possa conceber. Em conseqüência, afirma-se que essas órbitas não têm significado físico.
Vê-se a Lua, enquanto percorre a sua órbita em torno da Terra, devido à luz solar que ela reflete em nossa direção. Ora, a luz transfere momento linear ao objeto pelo qual é refletida. Em princípio, essa luz refletida perturbaria o movimento da Lua em sua órbita, embora um raciocínio simples, mostre que esse efeito é desprezível devido as dimensões da lua. Em se tratando de elétrons, a situação é bastante diferente. Também, nesse caso, pode-se ver o elétron somente quando nele refletir luz ou outra partícula qualquer. Neste caso, o recuo que o elétron experimenta quando a luz (fóton) o atinge, altera completamente seu movimento de um modo que não pode ser evitado, ou mesmo corrigido. Esta incapacidade intrínseca em se descrever de modo clássico os movimentos do elétron é expressa pelo princípio da incerteza de Heisenberg. Para formular esse princípio, considere-se um feixe de elétrons mono energéticos, de velocidade v, deslocando-se da esquerda para a direita na Fig.3. Procura-se determinar a posição de um certo elétron de ordenada y e de velocidade vy . Caso se consiga medir essas grandezas com precisão ilimitada, poder-se-á afirmar ter-se estabelecido exatamente a posição e o movimento do elétron. Entretanto, ver-se-á ser impossível efetuar simultaneamente as duas medidas citadas com precisão ilimitada.
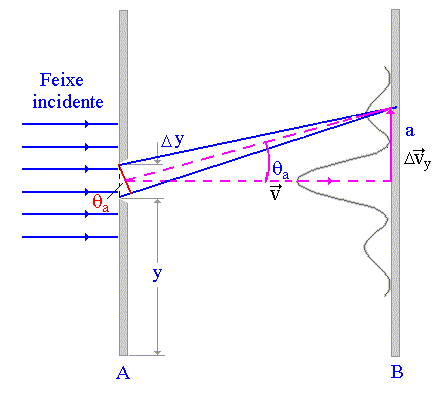
Como o elétron pode comportar-se como uma onda, sofrerá difração ao atravessar a fenda e, colocando-se uma chapa fotográfica em B (Fig. 3), obter-se-á uma figura de difração típica, equivalente à da simulação abaixo. A existência dessa figura de difração significa que existe uma incerteza nos valores de vy dos elétrons que ultrapassaram a fenda. Seja vya o valor de vy correspondente a uma elétron que atinge o primeiro mínimo do anteparo, indicado pelo ponto a e definido por um ângulo característico qa. Considera-se vya como uma medida aproximada da incerteza Dvy relativa ao valor da velocidade vy dos elétrons emergentes da fenda.
Interferência
por Difração (fenda única)
Modo
de usar: Com o botão esquerdo do mouse você pode variar
o
comprimento de onda (variando as cores), assim como modificar a abertura
da fenda
© Copyright 1997, Sergey
Kiselev and Tanya Yanovsky-Kiselev
Last modified: June 20, 1997
Sabemos, da difração da luz em fenda única, que a condição de mínimo ou interferência destrutiva, no espectro de difração é dada pela equação
O primeiro mínimo da figura de difração é dado pela seguinte equação acima, no caso n = 1
para qa suficientemente pequeno. Para atingir o ponto a, vya (= Dvy) deve ser tal que
.
Combinando as duas equações anteriores obtemos que
Ora, o comprimento de onda l do feixe de elétrons é dado por h/p ou h/mv; substituindo o seu valor na equação anterior, vem que
,
onde Dpy = mDvy é a incerteza no conhecimento sobre o momento dos elétrons; Dy é incerteza no conhecimento sobre a sua ordenada (ou posição). A equação assegura que , como o produto dessas incertezas é constante, não se poderá medir py e y, simultaneamente com precisão ilimitada. Para melhorar a medida de y usa-se uma fenda mais estreita, veja simulação acima para o caso de ondas luminosas. Entretanto isso resultará em espectro de difração mais largo. O aumento da largura do espectro de difração significa ter piorado o conhecimento da componente vertical do momento linear ou, em outras palavras, Dpy aumentou. É isso, exatamente, o que prevê o princípio de Heisenberg.
As limitações nos valores das precisões das medidas impostas pelo princípio de Heisenberg, nada têm a ver com as imperfeições dos aparelhos de medida. Pode-se até postular a existência dos mais perfeitos equipamentos de medida concebíveis. O princípio de Heisenberg representa uma limitação fundamental, imposta pela Natureza.

W. Heisenberg
Num caso mais geral, deste princípio, pode se afirmar que:
A constante de Planck, h, provavelmente não aparece em qualquer outra fórmula com um significado mais profundo do que nas equações acima. Se o aludido produto fosse igual a zero, em vez de h, estariam corretas as noções clássicas sobre partículas e órbitas.
![]() Exemplo
Exemplo
Um elétron, forçado
a se mover em uma dimensão, tem uma incerteza de posição =
1,0x10-8 metro. Determine a incerteza mínima em sua velocidade
escalar. Ache a incerteza correspondente para uma bola de 2 kg confinada
do mesmo modo.
Solução:
De acordo com o princípio
da incerteza de Heizenberg, temos que,
Para o elétron isto implica em uma incerteza de velocidade
Enquanto que para a bola de 2 kg,
Vemos, então muito claramente que a limitação que
a relação de incerteza impõe a corpos microscópicos
é muito mais significativa do que aquela que resulta no caso de
objetos macroscópicos.
|
|
|
![]() Enviar
mensagens para : kcmundim@unb.br
Enviar
mensagens para : kcmundim@unb.br
Last Updated: Jan/23/2002
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Chemistry Institute-UnB, Brasília
BRAZIL
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura