A radiação de qualquer fonte de luz pode ser estudada para determinar que tipo de comprimento de onda ou freqüência está presente. Por exemplo, uma lâmpada incandescente exibe um espectro contínuo de radiação, isto significa que um número infinito de freqüências diferentes podem ser emitidas pela lâmpada. Por outro lado, muitas outras fontes de luz emitem apenas em algumas freqüências bem definidas denominadas por linhas espectrais. Em particular, observa-se que um gás de hidrogênio emite radiações em um espectro reduzido e limitado. A seguir discutiremos o espectro de emissão do hidrogênio que é o sistema atômico mais elementar conhecido.
Antes do desenvolvimento da teoria quântica, esses complicados espectros de linha davam evidencias de que o átomo deveria ter uma estrutura bem definida. Acreditava-se então que os átomos tinham muitos modos possíveis de oscilações, como cordas de violinos ou tubos de órgãos, e que a excitação destes modos davam origem à radiação correspondente às suas freqüências individuais.
Até 1885, 14 linhas
espectrais de hidrogênio tinham sido identificadas e seus comprimentos
de onda precisamente medidos. No sentido de encontrar um modelo teórico
que explicasse esse fenômeno, Johann Balmer propôs uma expressão
matemática empírica que descreveu precisamente todos estes
comprimentos de ondas conhecidos. Balmer, empiricamente, mostrou que as
séries observadas de comprimentos de onda espectrais poderiam ser
expressas por
n = 3, 4, 5 .....
onde n se supôs serem valores inteiros, isto é, n = 3,4,5,6,..... e R é uma constante que agora é denominadas de constante de Rydberg. Na época o valor desta constante era de
Em seguida outras séries espectrais foram determinadas teoricamente com base na expressão de Balmer. A primeira delas foi apresentada por Paschen (1908) usando a relação;
n = 4, 5, 6 .....
Em seguida vieram as séries de Lyman e Brackett, as quais se referiam às regiões do infravermelho e ultravioleta do espectro de emissão do gás de hidrogênio, respectivamente. Estes espectros podem ser descritos pelas equações de Balmer modificada,
Lyman
n = 2, 3 .....
Brackett
n = 5, 6, 7 .....
Assim, determinou-se empiricamente que os espectros de linhas distintas emitidos pelo hidrogênio poderiam ser ajustados pela relação de Balmer generalizada:
onde m e n são números inteiros. Como o comprimento de onda é uma grandeza positiva, os inteiros m e n devem satisfazer à desigualdade m < n. A Fig. 2 mostra as séries espectrais conhecidas e descritas pela regra de Balmer.
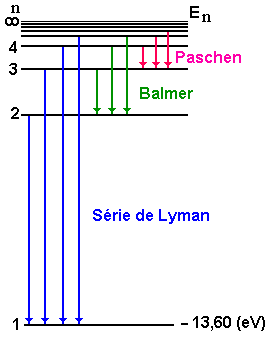
Fig-1 Diagrama de níveis de energia do
hidrogênio:transições de Paschen, Balmer e
Lyman.
Espectro Eletromagnético
Como discutido anteriormente, o modelo
planetário para o átomo de hidrogênio proposto por
Rutherford era coerente com as observações experimentais,
porém não era consistente com a física conhecida e
aceita na época. Em particular, este modelo não explicava
as linhas espectrais do átomo de hidrogênio, como mostrado
anteriormente. Tornou-se, então, evidente que a física clássica
não conseguia descrever os elétrons no átomo.
Surge então o físico dinamarquês Niels Bohr, o qual
refletindo sobre o trabalho de Rutherford concluiu que seria necessário
desenvolver novos princípios teóricos.
O ponto de partida de Bohr foi admitir que a luz
emitida por substâncias químicas quando levadas ao calor
ou sob efeito de um campo elétrico ocorre porque os elétrons
absorvem energia (térmica ou elétrica) e depois a emitem
a energia recebida na forma de luz. Mas ainda persistia a seguinte dúvida:
como explicar o fato de que o espectro emitido pelo átomo de hidrogênio
possui um número discreto de linhas?
Investigações do espectro de luz emitido pelo átomo de hidrogênio e o conhecimento dos trabalhos de Planck levaram Niels Bohr a postular que o movimento eletrônico, em torno do átomo, se dava em órbitas circulares e energias bem definidas, Fig.3. Isto é, o elétron não poderia se mover em qualquer órbita e, conseqüentemente, não poderia ter qualquer valor de energia associada, mas apenas alguns valores discretos. A isto, Bohr denominou como a quantização das órbitas atômicas ou quantização da energia eletrônica. O seu modelo de átomo de hidrogênio teve um notável sucesso no cálculo dos comprimentos de onda das linha do espectro conhecido do hidrogênio e na previsão das linhas nos espectros de infravermelho e de ultravioleta.
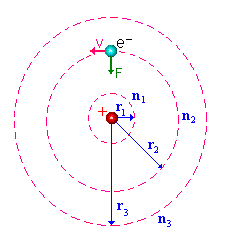
Então, de acordo com o modelo de Bohr, o elétron
no átomo de hidrogênio percorria uma órbita circular
de raio r, concêntrica em relação ao núcleo.
Ele admitiu ainda que o núcleo consistia de um único próton,
cuja massa era muito superior à do elétron. Neste caso, pode-se
considerar que o centro de massa do átomo esteja em cima do núcleo,
isto é, toda a massa do átomo está centrada no núcleo.
Com base nos postulados de Bohr e nas leis de Newton pode-se mostrar que
as órbitas têm energias bem definidas e quantizadas. Como
mostraremos a seguir.
A simulação abaixo ilustra o processo de absorção
e emissão de fótons por um átomo. Observe que inicialmente
o elétron se localiza no nível de mais baixa energia (estado
fundamental) e, em seguida, absorve a energia de um fóton o que promove
a transição para um nível de energia superior. Como
este estado não é o de mais baixa energia, o elétron
volta ao nível inferior emitindo, para isto, um fóton com
energia igual à que o elétron recebeu inicialmente.
A seguir, discutiremos as idéias de Bohr. Esse modelo, embora deficiente sob diversos pormenores, ilustra as idéias da quantização dentro da moldura matemática mais simples da Física Clássica. As idéias clássicas usadas na descrição das órbitas eletrônicas eram incapazes de explicar os espectros do átomo de hidrogênio. Usando a idéia dos osciladores de Planck, Bohr propôs um modelo que explicasse o espectro do átomo de hidrogênio. De acordo com Bohr, no átomo de hidrogênio, só existem estados estacionários, nos quais não há irradiação, mesmo que os elétrons estejam em movimento. A irradiação só aparece quando o átomo efetua uma mudança de um dado estado, de energia Em, para outro de menor energia En. Matematicamente podemos equacionar esta hipótese por,
onde hn é o quantum de energia associado ao fóton que é emitido pelo átomo durante a transmissão. Para saber as freqüência permitidas, pela equação de Bohr será necessário conhecer as energias dos diversos estados estacionários em que um átomo de hidrogênio pode existir. Esse cálculo foi efetuado, pela primeira vez, por Bohr, baseando-se no modelo específico do átomo de hidrogênio, por ele imaginado. O modelo de Bohr teve sucesso apenas no caso do átomo de hidrogênio, mas, mesmo assim, influenciou muito o desenvolvimento posterior na Física e Química Quântica.
Suponha-se que o elétron do átomo de hidrogênio percorra uma órbita circular de raio r, concêntrica com o núcleo. Admita-se, ainda, que o núcleo, consista em um único próton que tenha uma massa muito superior à do elétron. Neste caso, pode-se considerar que o centro de massa do átomo esteja no centro do núcleo. Usando as leis de Newton, podemos escrever algumas equações relacionadas ao movimento do elétron em torno do núcleo, como por exemplo:
Para o elétron ficar fixo na órbita é necessário que as forças centrípeta e coulombiana sejam iguais;
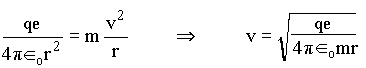
onde v é a velocidade do elétron em torno do núcleo. Com isto, podemos calcular as energias cinética e potencial do elétron por
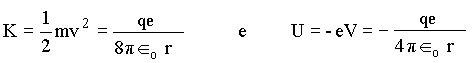
onde r é o raio da órbita do elétron e Îo a constante dielétrica. Dessa forma a energia total é igual a
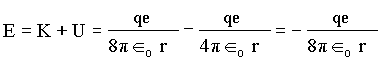
Percebemos que estas grandezas são todas dependentes de r então, se quantizarmos r, conseqüentemente a energia será quantizada. Vamos escrever outras equações para este problema, os quais também dependem de r.
Como por exemplo a freqüência, o momento linear e o momento angular, respectivamente
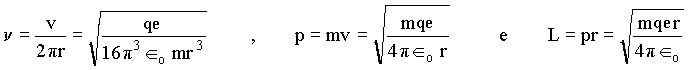
Portanto, conhecendo-se r, todos os parâmetros da órbita discutidos acima serão determinados. Até este estágio, Bohr não dispunha de regras que o orientassem, de modo que foi forçado a fazer a hipótese de quantização do momento angular, isto é, o momento angular deveria ser igual a um múltiplo inteiro da constante de Planck dividida por 2p . Assim,

onde n é um número inteiro ou um número quântico. Combinando esta equação com a equação anterior para o momento angular percebemos que r será quantizado,
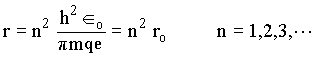
Onde ro é o raio de Bohr. Substituindo r na equação para a energia temos que,
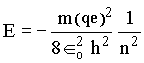
O sinal menos indica que é necessário ceder energia ao átomo para retirar elétrons.
Com isto podemos determinar
os valores das energias dos estados estacionários permitidos. A
Fig. 2, mostra o diagrama de níveis de energias para o átomo
de hidrogênio, levando em conta a hipótese de Bohr. Podemos
perceber que a medida que n cresce tendendo ao infinito, os níveis
de energia se aglomeram, isto é a distância entre eles diminui.
O novo modelo de Bohr
pode ser resumido nos seguintes postulados:
a) um elétron descreve órbitas circulares ao redor do núcleo;
b) as órbitas diferem entre si pelo raio e pela quantidade de energia;
c) um elétron pode encontrar-se em uma série limitada de
órbitas;
d) a passagem de um elétron de uma órbita para a outra envolve
absorção ou emissão de energia, conforme o
elétron se mova para uma órbita mais externa ou mais interna,
respectivamente;
e) enquanto permanecer em uma órbita, o elétron é
dito estacionário e não emite energia;
f) cada órbita é caracterizada por um número quântico
(n), que pode assumir valores inteiros (1,2,3,4...).
Desta maneira, cada átomo tem disponível um conjunto de energias quantizadas, ou níveis de energia, para seus elétrons. Quando no estado fundamental, os elétrons encontram-se nas órbitas com menor energia (ou mais internas) disponíveis no átomo. Quando o átomo absorve energia (pela chama ou descarga elétrica), seus elétrons passam a níveis de energia mais altos (ou órbitas mais externas) passando então para um estado excitado. Para retornar agora ao estado fundamental, os elétrons “caem” para as órbitas de menor energia, emitindo um fóton de luz com energia igual à diferença entre as duas órbitas. Veja simulação acima.
Procedendo de forma análoga ao que fizemos na quantização da energia podemos encontrar uma equação para a freqüência em termos do número quântico n;
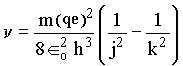
sendo k e j números inteiros, os quais descrevem duas órbitas consecutivas.
Para um elétron passar de um nível para outro ele deve emitir ou receber energia em quantidade bem determinada, isto é receber um quantum de energia.
Sejam por exemplo, dois níveis eletrônicos k e j, onde j é superior a k, então para ir de j até k o átomo deve emitir energia na forma de luz cuja freqüência pode ser determinada calculando-se a diferença de energia entre os dois níveis:
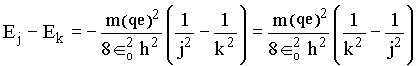
se k = 1 e j = 2, temos que
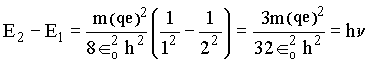
Assim, a freqüência da radiação associada ao processo de transição de um nível para o outro é:
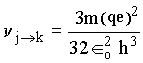
Analisando a equação para a diferença de energia e a Fig. 2, notamos que, para níveis altos ou n grande, o espaçamento entre eles passa a ser quase um contínuo. Este limite seria, em princípio, um dos limites entre as teorias clássica e quântica. Pode-se mostrar matematicamente que, usando a equação para diferença de energia, para n no infinito temos um contínuo na separação entre os níveis. Este limite é conhecido como o princípio da correspondência, o qual será discutido na próxima seção.
A equação acima, referente a variação da energia devido à transição do elétron em dois dois níveis energéticos, por exemplo, entre os níveis i e j, pode ser usada para se obter a equação de Balmer apresentada no início desta seção, isto é,
A freqüência e o comprimento de onda estão conectados pela velocidade da luz (c), como a seguir,
Comparando-se as duas últimas equações obtém-se
a equação de Balmer que descreve as raias espectrais do átomo de
Hidrogênio, isto é:
Lembre-se que Balmer havia proposto esta equação de forma totalmente empírica
e agora ela pode ser obtida dentro do modelo de Bohr.
![]() 3- Princípio da Correspondência
3- Princípio da Correspondência
Embora todas as teorias da Física tenham suas limitações, geralmente não perdem a validade abruptamente, mas sim de uma maneira contínua, dando resultados que concordam cada vez menos com o experimento. É assim que as previsões da Mecânica Newtoniana se vão tornando menos precisas, à medida que a velocidade tende à da luz. Uma correlação semelhante deve existir entre as Físicas Quântica e Clássica; resta achar as circunstâncias sob as quais a última passa a constituir um caso especial da primeira.
O raio da órbita do átomo de hidrogênio, correspondente ao estado de mais baixa energia (chamado estado fundamental), o qual é obtido fazendo-se n = 1. Neste caso o raio quantizado ele vale r = 5,3x10-11 Å (angström). Para n = 10.000, entretanto, o raio tornar-se-á (10.000)2 vezes maior, ou seja 5,3mm. A este nível de separação espera-se que as freqüências calculadas tanto pela teoria quântica quanto pela teoria clássica devem ser praticamente iguais. O fato da Física Quântica se reduzir à Física Clássica para números quânticos muito grandes é denominado Princípio da Correspondência, o qual foi proposto por Niels Bohr no início do desenvolvimento da física e química moderna.
A seguir faremos algumas comparações para as freqüências clássicas e quânticas no caso de números quânticos grandes. As freqüências clássicas e quânticas são dadas por;
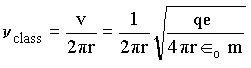
para uma órbita n, temos que
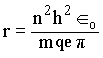
Daí tiramos que a freqüência clássica,
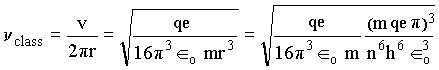
ou de forma simplificada
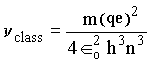
No caso quântico, a freqüência é dada pela diferença de energia,
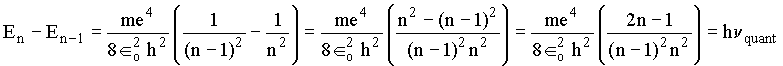
para n grande (n ® ¥ ) temos as seguintes aproximações : 2n-1 » 2n e n –1 » n. Assim, a freqüência quântica vem dada por:
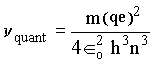
Comparando os resultados
obtidos para as freqüências clássicas e quânticas
concluímos que elas são iguais no caso de números
quânticos grandes confirmando, assim, o Princípio da Correspondência
de Bohr.
|
|
|
![]() Enviar
mensagens para : kcmundim@unb.br
Enviar
mensagens para : kcmundim@unb.br
Last Updated: Jan/23/2002
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Chemistry Institute-UnB, Brasília
BRAZIL
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura