Vimos anteriormente
algumas
propriedades gerais da matéria, como por exemplo a massa e o
volume.
Existem outras propriedades como por exemplo a
solubilidade.
![]() 1- Teoria das
Soluções
1- Teoria das
Soluções
Quando duas ou mais
substâncias são misturadas, diversas
situações são possíveis:
As misturas
homogêneas são também conhecidas como
soluções. Nestes sistemas é importante destacar
que:
a) - um ou mais componentes
(soluto) são dissolvidos em outro que possui maior quantidade
(solvente),
b) - a quantidade
máxima possível de um soluto na
solução é definida com sendo a sua solubilidade no
solvente,
c) - tanto o solvente quanto o(s) soluto(s)
podem apresentar-se
nos três estados físicos,
d) - sendo que a
solução geralmente permanece no estado do solvente.
Portanto, podem ser verificadas soluções gasosas, líquidas ou sólidas. Na tabela abaixo, as diversas situações possíveis para uma solução são apresentadas.
|
SOLVENTE |
SOLUTO |
SOLUÇÃO |
EXEMPLO |
|
Gás |
Gás |
Gasosa |
Ar |
|
Líquido |
Gás |
Líquida |
H2O + O2 |
|
Líquido |
Líquido |
Líquida |
H2O + HI |
|
Líquido |
Sólido |
Líquida |
H2O + NaF |
|
Sólido |
Gás |
Sólida |
Ni + H2 |
|
Sólido |
Sólido |
Sólida |
Zn + Cu |
![]() 2- Solubilidade
2- Solubilidade
O grau de solubilidade de
uma substância em um dado solvente pode ser expresso de
vários
modos e é em geral função
da temperatura. Um método comum consiste em dizer o
número de
gramas
de uma dada substância que se dissolvem em 100 g de solvente a
uma
dada temperatura. A 25 ºC, cerca de 40 g de nitrato de
potássio
(KNO3) dissolvem-se em 100 g de água. A 100 ºC,
a solubilidade
deste
sólido é consideravelmente maior, cerca de 240g/100g de
água.
![]() Exemplo:
Exemplo:
Sendo a solubilidade do cloreto de sódio, NaCl, igual a 36g/100 g de água a 25 ºC, calcule a massa de NaCl que é dissolvida em 120 g de água nesta temperatura.
Conhecendo a solubilidade do NaCl em H2O, podemos montar a seguinte relação de equivalência;
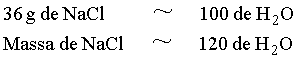
Desta relação proporcionalidade tiramos a seguinte relação :
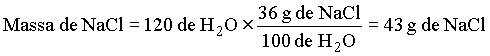
![]() 3- Separação de Misturas
3- Separação de Misturas
A separação
de misturas em suas substâncias componentes é uma
técnica
essencial tanto nos laboratórios de pesquisas quanto na
industria.
Como vimos anteriormente as substâncias, na natureza, raramente
ocorrem
em um estado puro e em geral antes delas serem usadas são
separadas
nas diferentes substâncias componentes, que algumas vezes
são
denominadas de impurezas. Os químicos usam freqüentemente
diferentes
procedimentos na separação de misturas. Três deles
são os mais comuns: a cristalização, a
destilação
e a cromatografia.
![]() 3.1
Cristalização
3.1
Cristalização
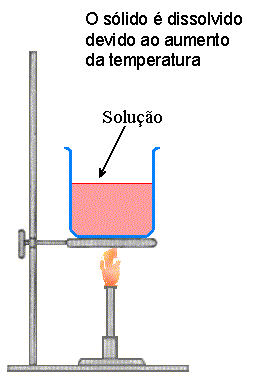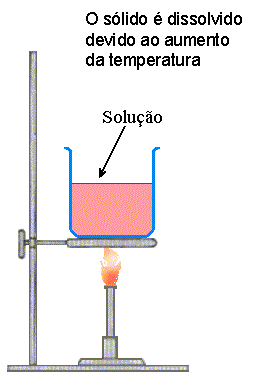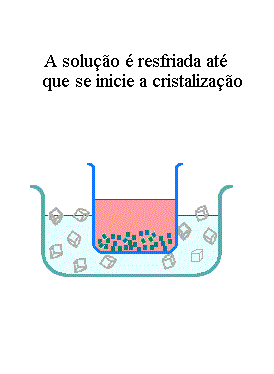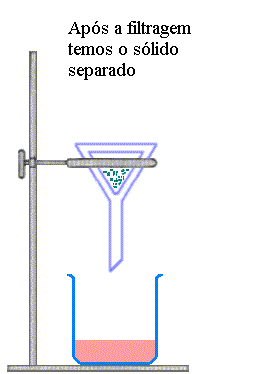
O método de
purificação
via cristalização depende das mudanças na
solubilidade
de uma substância em função da temperatura.
Suponha,
por exemplo, que nós temos reservatório contendo 80 g de
nitrato de potássio, KNO3, 10 g de cloreto de
potássio
KCl, e nós queremos obter uma quantidade de nitrato de
potássio
pura. Primeiramente, dissolvemos a mistura de nitrato de
potássio-cloreto
de potássio em, por exemplo, 100 g de água a uma
temperatura
de 100 ºC. Se resfriamos lentamente esta solução,
ela
torna-se saturada com nitrato de potássio à 50 ºC e
o nitrato de potássio começa a se cristalizar nesta
solução.
Se a solução é cristalizada a 0 ºC, 67 g de
nitrato
de potássio puro cristaliza; somente 13 g permanece na
solução
porque a sua solubilidade é 13 g em 100 g de água a 0
ºC.
Sendo que a solubilidade do cloreto de potássio a esta
temperatura
é de 27 g por 100 g de água, todas 10 g de cloreto de
potássio
permanecerá na solução.
Em seguida podemos separar
o nitrato de potássio sólido a partir da
solução
por um processo de filtração, o qual é mostrado na
figura abaixo. Neste processo de cristalização,
percebe-se
que o nitrato de potássio e o cloreto de sódio não
são separados completamente, pois parte de ambos
permanecerão
ainda na solução. A cristalização é
um processo de purificação relativamente eficiente,
particularmente
quando a quantidade de impurezas não é muito grande e a
solubilidade
não são muito pequenas.
Fig. 1.5 Cristalização
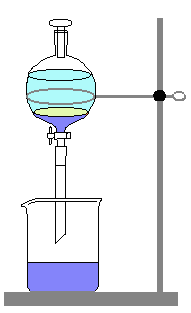
A destilação é um processo eficiente e conveniente para separar líquidos a partir de soluções de sólido-liquído. O método é baseado na diferença da volatilidade de das várias substâncias. Por exemplo, água pura pode ser obtida da água do mar em aparelhos do tipo mostrado na Fig. 1.6. Quando a água do mar é aquecida até próximo de 100 ºC, ela eventualmente começa a evaporar. Por outro lado o cloreto de sódio e os outros solutos não são voláteis a esta temperatura, isto é, eles não vaporizam. Em seguida o vapor de água começa a se condensar, ao passar pela tubulação do destilador (Fig.1.6). Então o vapor de água é esfriado e muda consequentemente para líquido. Este processo é conhecido como condensação. Em seguida a água pura escorre pela tubo até um reservatório de coleta. O sólido que permanece no recipiente, após toda a água ter sido removida, contém o cloreto de sódio com as outras substâncias contidas na água inicialmente.
A destilação também é usada para separar a solução de dois ou mais líquidos. Neste caso a separação não será total até que os dois líquidos atinjam os seus respectivos pontos de ebulição. Veja abaixo a simulação sobre o funcionamento de um destilador.
![]() 3.3
Cromatografia
3.3
Cromatografia
O nome cromatografia
é
derivado da palavra grega chroma, "cor". Existem várias
tipos
de cromatografias, mas todas elas são baseadas no mesmo
princípio.
Umas das técnicas mais usuais faz-se uso do papel de
cromatografia,
o qual pode separar, em cores, as substâncias diferentes da
solução
observada. Em geral este papel contém uma tinta que permite que
algumas substâncias mova-se mais ou menos rapidamente que outras.
Em outras palavras podemos dizer que as diferentes substâncias
têm
diferentes taxas de mobilidade no papel cromatógrafo. A Fig.
(1.7)
mostra o processo de separação de diferentes
substâncias.
Este processo é
eficiente
na identificação das diferentes substâncias
contidas
em uma solução, mas não é muito usual
separar
grandes quantidades de substâncias em uma mistura. Nestes casos
usa-se
freqüentemente o processo de cromatografia líquido-colunas.
No caso de gases e líquidos voláteis usa-se processo de cromatografia de coluna gasosa.

![]() 4.4
Decantação
4.4
Decantação
A
decantação é um processo mecânico de
separação
de misturas heterogêneas de um sólido em um líquido
ou dois líquidos imiscíveis entre si, como por exemplo
areia
em suspensão num vasilhame com água. Neste caso
percebe-se,
com o passar do tempo que a areia se deposita no fundo do
reservatório.
Em seguida, com um auxílio de um sifão, esgota-se ou
drena-se
a água do reservatório restando no mesmo apenas os
grãos
de areia.
No caso de uma
mistura sólido-líquido, o método mais utilizado
para efetuar a separação é a
filtração. Ou seja, faz-se passar a mistura por um meio
filtrante, como papel poroso, um tecido ou uma porcelana porosa. O meio
filtrante irá reter o sólido e permitir que o
líquido escoe.
Já para separar uma mistura heterogênea de
líquidos imiscíveis, utiliza-se o processo de
separação denominado
decantação. Para tal, utiliza-se o funil
de separação, também chamado pêra
de decantação, como mostrado na figura abaixo.
Após deixar o funil em repouso em um suporte apropriado, a fim
de que haja a separação das fases do sistema, retira-se a
tampa superior do funil e abre-se a torneira deixando escoar o
líquido mais denso.
![]() Voltar
à página
principal
Voltar
à página
principal
![]() Voltar ao início desta página
Voltar ao início desta página
![]()
O conteúdo desta
página está em constante atualização.
Correções no texto e
sugestões serão bem-vindas.
![]() Electronic Address : kcmundim@unb.br
Electronic Address : kcmundim@unb.br
Last Updated: Out/22/2000
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura
phone: 55 61 3307 2150