![]() 1-
Estados da Matéria
1-
Estados da Matéria
A
matéria pode se apresentar basicamente em três estados denominados
estados
da matéria: o gasoso, o líquido e o sólido. No
estado sólido os corpos apresentam formas e volumes constantes.
O arranjo entre os átomos e moléculas é bem definido.
No estado líquido os corpos apresentam forma variável e volume
constante o arranjo atômico e molecular é variável.
No estado gasoso os corpos apresentam forma e volume variáveis.
A força de repulsão entre os átomos e moléculas
é maior que a força de coesão.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Estudaremos mais detalhadamente, nas próximas seções,
cada um desses estados da matéria.
![]() 2-
Fenômeno Físico e Químico
2-
Fenômeno Físico e Químico
Um
fenômeno é toda mudança que ocorre em um sistema em
observação. Em Química podemos classificar os fenômenos
em dois grandes grupos: os fenômenos físicos e fenômenos
químicos.
|
|
De um lado temos os reagentes e de outra os produtos. A queima (combustão) do Magnésio é uma reação típica onde ocorre o fenômeno químico. Isto é 2 átomos de magnésio metálico reagem com 1 molécula de gás de oxigênio formando 2 íons de óxido de magnésio sólido.
Observe na reação acima que o número de átomos
antes e depois da reação ser processada se conserva. O que
ocorre é uma reorganização da distribuição
dos átomos formando novas moléculas. Em alguns casos o fenômeno
químico é irreversível, como por exemplo a queima
do carvão produzindo moléculas de CO2 consumindo
para isto átomos de carbono e moléculas de oxigênio.
|
|
A mudança de fase ou estado físico, como ocorre na liquefação
da água, isto é, aquece-se um bloco de gelo e tem-se a água
no estado líquido. Este é um fenômeno reversível,
isto é basta resfriar o líquido para voltar ao estado sólido
(bloco de gelo). Quando uma substância é submetida a um fenômeno
físico, suas características químicas não se
alteram, pois as moléculas permanecem intáctas. No exemplo
acima, em qualquer das duas situações, a molécula
de água será composta por 2 hidrogênios e 1 oxigênio
(H2O).
Neste tema duas palavras (reagir e misturar)
são comuns e algumas vezes são usadas de forma errônea.
Reagir
é um fenômeno químico, pois muda a natureza da matéria.
Misturar é fenômeno físico pois não muda a natureza
da matéria. Por exemplo misturando pó de ferro em água,
obtemos uma mistura
![]() 3-
Mudança de Estados da Matéria
3-
Mudança de Estados da Matéria
Uma das propriedades da matéria é a sua capacidade de mudar de estado. Isto ocorre devido a influências externas tais como a variação da temperatura e da pressão entre outros fatores. Como por exemplo, ao aquecer um bloco de gelo (água sólida), este absorve calor e se transformar em líquido. Esta mudança, passagem do estado sólido para o líquido é comumente denominada por fusão ou liquefação. Existem basicamente cinco mudanças de estados possíveis como mostra a figura abaixo,
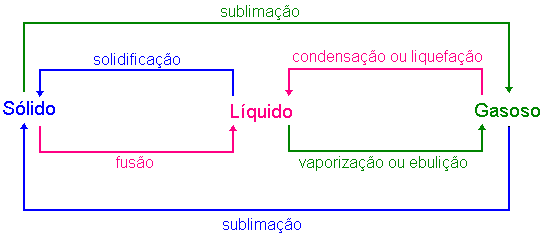
A
Fusão é a passagem do estado sólido para o estado
líquido. Em geral esta transformação ocorre devido
a absorção de energia em forma de calor, por isto
é
denominada por transformação
endotérmica.
Neste
sentido a transformação endotérmica implica em um
aumento da energia do sistema. Por exemplo, um aumento na temperatura
de
um bloco de gelo induz a mudança de fase do estado sólido
para o líquido. Neste caso, podemos dizer que a
água
no estado líquido tem mais energia que no estado sólido
(gelo).
Se continuar aumentando a temperatura da água no estado
líquido,
no exemplo acima, iniciará se o processo de
transformação
denominado de vaporização, comumente também
chamado
de evaporação ou ebulição. No final deste
processo
tem-se a água no estado gasoso.
Se o processo é invertido, isto é, diminuindo a
temperatura
da água no estado gasoso induz-se a mudança de fase
(gás-líquido)
denominada condensação. Ao refriar mais ainda este
sistema,
começa-se a transformação denominada
solidificação
ou mudanção de fase líquido-sólido.
Mas este fato
não ocorre somente com o gelo. Muitas outras
substâncias cristalinas e homogêneas passam por isso,
só que não exatamente
na mesma temperaturas que a mostrada no exemplo acima. Veja uma
tabela com
as temperaturas onde ocorre a fusão (passagem do estado
sólido para o
líquido) em algumas outras substâncias (sempre a
pressão ambiente)
| substância | Ponto de fusão (°C) |
substância |
Ponto de fusão (°C) |
|
| água | 0 | estanho | 232 | |
| álcool | -114 | ferro | 1 535 | |
| alumínio | 659 | mercúrio | -39 | |
| cloreto de sódio | 800 | nitrogênio | -210 | |
| cobre | 1 083 | ouro | 1 063 | |
| chumbo | 327 | oxigênio | -219 | |
| enxofre | 119 | prata | 961 |
Nós sabemos que quem faz a vibração molecular (temperatura) aumentar é o calor recebido de alguma fonte externa (Sol, fogo, resistência elétrica etc). Vamos então aprender a calcular a quantidade de calor (Q) necessária para que estas mudanças de estado ocorram.
Guarde bem uma coisa:
| Quando a temperatura de uma
substância está mudando, ela não pode estar ao
mesmo tempo mudando de
estado. Por outro lado, quando uma substância está
mudando de estado sua
temperatura sempre permanecerá constante. |
A energia fornecida pela fonte de calor à substância
servirá para
"quebrar" as ligações que mantinham as moléculas
do sólido unidas,
e não para aumentar a agitação das mesmas. .
Um fato interessante é que algums substâncias têm a
propriedade de passar diretamente do estado sólido para o gasoso
ou vice-versa. Esta transformação é denominada por
sublimação.
A
sublimação pode ser facilmente observada para o "gelo seco"
(dióxido de carbono congelado). A
condensação e a
deposição junto ao solo são visíveis como
orvalho
e geada. Os mesmos processos na atmosfera produzem nuvens.
![]() 4- A influência da Temperatura nas Transformações ou
Mudança de Fase
4- A influência da Temperatura nas Transformações ou
Mudança de Fase
Vimos
anteriormente que a mudança de tempetura é um fator externo
importante nas transformações de fases da matéria.
Vimos anteriormente que ao aquecer um bloco de gelo, fornecendo-lhe calor,
ele absorverá energia transformando-o em líquido. Este processo
é denominado fusão. Existe uma temperatura específica,
neste processo, denominada de ponto de fusão
que é a temperatura na qual uma substância passa do estado
sólido para o estado líquido. Se a substância é
pura, a temperatura permanece constante durante o processo de fusão.
(Fig.1). Apenas quando o sólido estiver fundido é que o aquecimento
produz um aumento de temperatura. O comportamento de um sólido impuro
em termos de fusão é completamente diferente. O sólido
geralmente inicia a fusão a uma temperatura abaixo do ponto de fusão
da substância pura. Além, disto a temperatura cresce continuamente
durante o processo de fusão, como mostra a Fig.2 . Portanto, qualquer
evidência de aumento na temperatura durante a fusão sugere
a presença de impurezas no sistema em estudo.
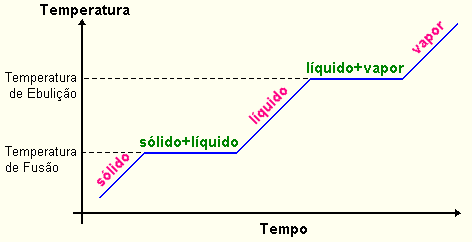
Fig.1 - Mudança de fase de uma substância pura
O ponto de ebulição de um líquido é a temperatura na qual são formadas bolhas cheias de vapor no interior do líquido. Veremos mais tarde que o ponto de ebulição depende da pressão exercida no líquido. O ponto de ebulição normal é a temperatura na qual um líquido ferve quando a pressão acima do líquido é 1 atm (760 mmHg). Para um líquido puro, a temperatura permanece constante durante a ebulição. A curva de ebulição é semelhante a de fusão.
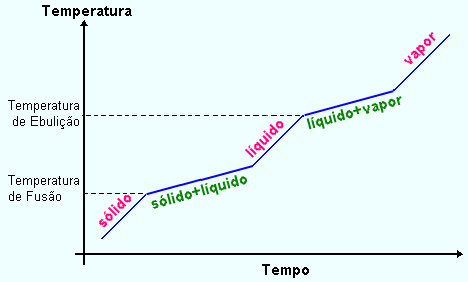
Fig.2 - Mudança de fase de uma substância não pura
ou misturas
Um experimento simples para verificar a mudança de fase em misturas é aquecer um cubo de água com açucar congelado. Neste caso, a temperatura nos estados de transição entre sólido-líquido ou líquido-vapor varia com tempo, diferentemente para uma substância pura onde a temperatura permanece constante. Veja gráfico na Fig.2. Este fenômeno deve-se principalmente ao fato de que tanto a água quanto o açucar têm ponto de fusão e ebulição diferentes.
Existem
outros dois tipos de misturas homogêneas denominadas Misturas
Eutéticas e Azeotrópicas,
para as quais nenhum dos processos acima se aplica.
No caso das Misturas Eutéticas os sólidos se fundem à
temperatura constante, mas o processo de ebulição ocorre
à temperatura variável. Veja gráfico na Fig. 3. Ligas
metálicas de prata (70%) e cobre (30%) são exemplos de misturas
eutéticas.
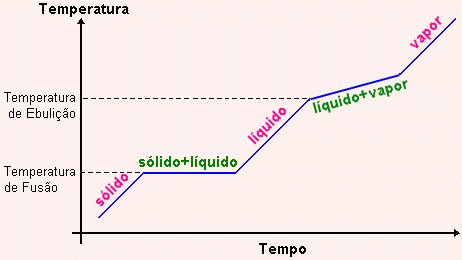
Fig. 3 - Mudança de fase em misturas eutéticas
As Misturas Azeotrópicas, por exemplo o álcool (95,5%) + água (4,5%), têm temperatura de fusão variável e temperatura de ebulição constante. Veja gráfico na Fig.4.
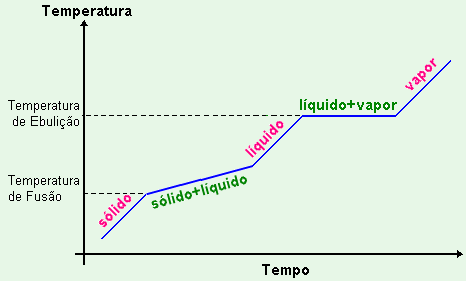
Fig. 4 - Mudança de fase em misturas azeotrópicas
![]() 5- Propriedades Específicas da Matéria
5- Propriedades Específicas da Matéria
Vimos anteriormente algumas
propriedades gerais da matéria, como por exemplo a massa e o volume.
Existem outras propriedades como por exemplo a densidade e a solubilidade.
![]() 5.1- Densidade
5.1- Densidade
Definimos o conceito densidade de uma substância como a razão de sua massa em relação ao seu volume.
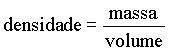
As unidades para a densidade de líquidos e sólidos são freqüentemente expressas em gramas por centímetro cúbico (g/cm3). Nos gases, as densidades são expressas, de um modo geral, em gramas por litro (g/l). Em particular, o mercúrio é um dos líquidos mais densos que se conhece. A sua densidade é aproximadamente igual a 13,6 g/cm3 e a água tem densidade igual a 1 g/cm3, com isto podemos dizer 10 cm3 de água pesa 1 kg.
A tabela abaixo mostra algumas propriedades físicas de algumas substâncias.
|
|
(g/cm3) |
(ºC) |
(ºC) |
(g/100 g água) |
|
(J/g ºC) |
| Elementos | ||||||
| Bromo (l) |
|
-7
|
59
|
|
Vermelho |
|
| Cloro (g) |
|
-101
|
-34
|
|
Verde-vermelho |
|
| Cobre (s) |
|
1083
|
2567
|
|
Vermelho |
|
| Ferro (s) |
|
1535
|
2750
|
|
Cinza |
|
| Magnésio (s) |
|
650
|
1120
|
|
Cinza |
|
| Compostos | ||||||
| Benzeno (l) |
|
5
|
80
|
|
Incolor |
|
| Álcool Etílico (l) |
|
-112
|
78
|
|
Incolor |
|
| Nitrato de potássio(s) |
|
334
|
-
|
|
Branco |
|
| Cloreto de sódio (s) |
|
808
|
1473
|
|
Branco |
|
| Água (l) |
|
0
|
100
|
|
Incolor |
|
![]() 6- Lei dos Gases
6- Lei dos Gases
Nós vivemos na superfície da Terra imersos em uma mistura de gases chamada de atmosfera. A atmosfera é essencial não apenas para a manutenção da vida, mas também tem um papel importante na manutenção da temperatura assim como do clima terrestre como um todo. Ela é também a fonte de muitos elementos químicos de grande importância industrial. Na história da química, a atmosfera sempre teve um papel extremamente importante. O ar foi um dos primeiros gases a ser estudado e destes estudos derivaram-se as primeiras lei científicas para os gases. Podemos encontrar gases por todo universo e são parte importante na formação dos sistemas solares e galáxias. Veja a simulação abaixo.
Nesta seção
examinaremos a natureza e comportamento físico dos gases em geral
e dedicaremos atenção específica aos gases ideais.
Veremos que, diferentemente dos líquidos e sólidos, todos
os gases se comportam de forma muito semelhante ao mudar as condições
iniciais tais como pressão, temperatura e volume.

|

|

|
O estudo dos gases têm sido importante desde os mais remotos desenvolvimento da ciência. Como dissemos o ar foi o primeiro gás a ser estudado muito antes mesmo dos cientistas entenderem que ele é uma mistura de um número grande de diferentes elementos e compostos. Observaram, que todos os gases podem ser descritos em termos de quatro propriedades fundamentais: a massa, o volume, a pressão e a temperatura.
Nós vivemos na superfície da Terra e sobre uma pressão atmosférica. A atração gravitacional da Terra sobre os gases da atmosfera leva a atmosfera a exercer uma força sobre todos objetos na superfície terrestre, inclusive sobre o nosso corpo. A pressão é definida como força por unidade de área (P = F/A). A pressão atmosférica é a força exercida pela atmosfera em uma unidade de área na superfície da terra, a qual foi estudada e medida pelo físico italiano Evangelista Torricelli (1608-1647). Ele usou um instrumento, conhecido hoje como barômetro de Torricelli ou barômetro de mercúrio, como mostra a figura 1. Este instrumento é formado por um tubo de vidro longo (76 cm comprimento) preenchido com mercúrio por uma de suas extremidades aberta. Em seguida a extremidade aberta do tubo é colocada dentro de um recipiente como mostra a figura 1. O que se observa é que haverá uma transferência de parte do mercúrio do tubo para o recipiente. A questão que se coloca é: Qual é a quantidade de mercúrio que será transferida do tubo para o recipiente ? Este processo pode ser explicado levando em conta o balanceamento das pressões exercidas pelo peso da coluna de mercúrio e a pressão exercida pela atmosfera. O peso da coluna de mercúrio fará com que o líquido sai do tubo no sentido de esvaziá-lo, contrariamente, a pressão atmosférica externa exercerá uma força no sentido empurrar o líquido para dentro do tubo. Assim, no equilíbrio, temos um balanceamento entre as duas forças exercidas sobre o líquido e com isto podemos medir a pressão atmosférica em função da altura h da coluna de mercúrio. Observa-se também que o peso da coluna de mercúrio suportada pela atmosfera, ou a pressão atmosférica, varia com as condições climática e decresce com a altitude. Ela equivale normalmente suportar uma coluna em torno de 76 cm = 760 mm de mercúrio ao nível do mar. Um milímetro de mercúrio é denominado por torr em homenagem a Torricelli. A pressão de 760 mm Hg é denominada de pressão padrão.
1 atmosfera = 1atm = 760 mm Hg = 760 torr
Contudo, a pressão é força por unidade de área, e ela seria então medida em unidades correspondentes, tal com : Newton por metro quadrado (N/m2) que é denominada de Pascal (Pa).
Fig.-1 Barômetro de Torricelli
![]() 7- Pressão e Volume : Lei de Boyle
7- Pressão e Volume : Lei de Boyle
Nós somos familiares com o fato de que os gases são compressíveis. Quando a pressão em uma certa quantidade de gás é aumentada, como por exemplo ao encher o pneu de uma bicicleta, o volume do gás diminui; isto é quando maior for a pressão menor será o volume. Em 1660 o químico irlandês Robert Boyle (1627-1691) estudou os efeitos da pressão no volume de ar usando o instrumento mostrado na figura 2.
Boyle encontrou que se a pressão sobre o gás fosse duplicada o volume do gás diminuiria pela metade; se a pressão fosse aumentada de quatro vezes, o volume diminuiria na mesma proporção, isto é diminuiria para um quarto do seu volume inicial. Em outras palavras, Boyle havia descoberto uma lei mais geral que estabelecia a seguinte relação entre volume e pressão:
A pressão vezes o volume é uma constante para uma dada quantidade de gás à temperatura constante.
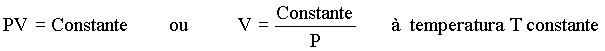
Esta relação tem mostrado ser válida para qualquer tipo de gás e é conhecida como lei de Boyle. Se calculamos esta relação para o mesmo reservatório de gás, à temperatura constante, mas sobre pressão diferente encontramos a seguinte relação de igualdade:
![]()
Modo de usar: Com
a tecla esquerda do mouse você pode a Pressão.
Varie a pressão e veja o comportamento
do gás no interior do cilindro.
![]() 8- Temperatura e Volume : Lei de Charles
8- Temperatura e Volume : Lei de Charles
Os estudos sobre as propriedades dos gases foi impulsionado pelos trabalhos do cientista francês Jacques Charles (1746-1823). Em seus estudos, ele mostrou que, à pressão constante, o volume de um gás aumentaria numa forma linear a medida que a temperatura aumentasse, como mostra a figura 3,
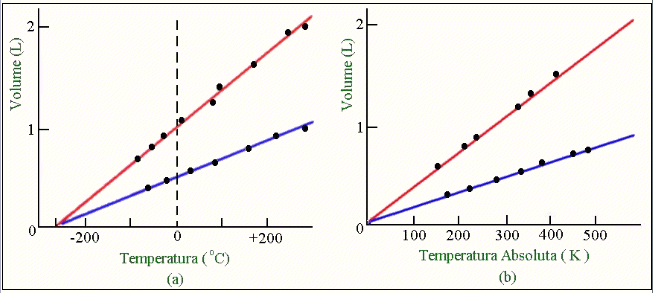
Fig.3 Escala de temperatura
Contrariamente, no processo de resfriamento, o volume do gás diminuiria à mesma proporção. Ele determinou, experimentalmente, que o volume de um dado reservatório de gás aumentaria por 1/273 partes do seu volume inicial ao variar a temperatura de 0oC para 1oC. Contrariamente, no resfriamento, o volume do gás diminuiria na mesma proporção (1/273) com o decrescimento da temperatura de 1oC para 0oC. Isto leva a uma conclusão surpreendente de que o volume se tornaria nulo a –273oC ou zero absoluto. Isto pode ser visto extrapolando a linha reta desenhada na figura 3. Como não podemos ter fisicamente volumes negativos, de acordo com o resultado de Charles, somos forçados a concluir que existe um limite para a temperatura, e este limite seria então –273oC, o qual é frequemente denominado de zero absoluto para a temperatura.
A lei de Charles pode ser resumida na seguinte expressão matemática:
![]() .
.
Se a temperatura é expressa na escala Kelvin, o volume de um gás é diretamente proporcional à temperatura, o que não é verdade se a temperatura é expressa na escala Celsius (veja figura 3). Destes resultados podemos mostrar que a seguinte relação é também válida:
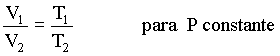
onde T é a temperatura na escala Kelvin. Esta expressão resume a lei de Charles em,
À pressão constante o volume de uma massa de gás é proporcional à sua temperatura na escala Kelvin.
Modo de usar: Com
a tecla esquerda do mouse você pode a Temperatura.
Varie a T e veja o comportamento do gás
no interior do cilindro.
A relação entre as escalas Kelvin e Celsius é dada por;
T = t + 273.15
Onde T é temperatura na escala Kelvin e t é a temperatura
na escala Celsius.
![]() 9- Lei dos Gases Combinada
9- Lei dos Gases Combinada
Combinando a lei de Boyle, a qual estabelece que a temperatura constante V µ 1/P, e a lei de Charles, a qual estabelece que a pressão constante V µ T, obtemos uma relação entre o volume, temperatura e pressão para uma dada quantidade de gás,

Rearranjando esta equação obtemos que PV/T = constante para uma dada massa de gás e que para diferentes condições de pressão, volume e temperatura, a seguinte igualdade é válida;
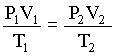
Esta equação é conhecida como lei
combinada dos gases.
Modo de usar: Com
a tecla esquerda do mouse você pode variar o Volume, a Pressão
e o Número de Partículas. Faça
isto e veja o comportamento do gás no interior do cilindro
![]() 10- O Gás Ideal
10- O Gás Ideal
Experimentalmente se observa, nos gases, que a pressão é proporcional ao número de colisões das moléculas que compõem o gás por unidade de área das paredes do recipiente, num dado instante. Se o volume e a temperatura do recipiente são constantes, o número de colisões por unidade de área em um dado instante é proporcional ao número de moléculas. Se um mol de moléculas sempre contém o mesmo número de moléculas (6,022 x 1023), segue-se que a pressão é proporcional ao número de mols das moléculas (n), ou

Na seção anterior vimos que
![]()
e
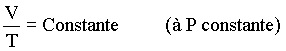
Combinando as três últimas relações obtemos
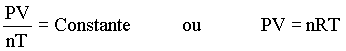
onde R é a constante chamada de constante dos gases. Se a pressão é expressa em atmosfera, o volume em litros e a temperatura em kelvins, R assume o valor de 0,0821 (atm L mol-1 K-1).
A última equação
é conhecida como equação
do gás ideal ou lei do gás
ideal. Ela é válida sobre certas condições
e para certos gases, portanto não é uma lei exata ou absoluta.
O comportamento do gases pode variar de acordo com os diferentes tipos
de moléculas. Isto deve-se ao fato das diferentes dimensões
e interações moleculares. Hipoteticamente, dizemos que os
gases nos quais o volume das moléculas e a força de interação
molecular é zero, obedecem a lei do gás ideal.
11- O Mol
Um dos usos mais importante da massa atômica é o de encontrar as massas das substâncias reagentes e dos produtos em uma reação química. A massa de uma molécula é a soma das massas de átomos que a compõem, isto é, é igual a soma das massas atômicas na fórmula molecular. Esta massa é chamada de massa molecular. Por exemplo, a fórmula molecular peróxido de hidrogênio (H2O2), entretanto a massa molecular é (2(1,008 u) + 2(16,00 u) que é igual 34,02 u. Tradicionalmente o termo peso molecular tem sido usado como um sinônimo de massa molecular de forma semelhante ao uso do termo peso atômico no lugar de massa atômica.
Nos estudos das reações em um laboratório estamos freqüentemente envolvidos com um número muito grande de átomos de moléculas. Por isto necessitamos de uma forma conveniente de transformar as informações advindas das fórmulas químicas e tabela de massas atômicas em uma unidade de medida prática.
A fórmula de CO diz-nos
que um átomo de oxigênio combina-se como um átomo de
carbono para formar a molécula de monóxido de carbono.
|
Para 1 átomo de C e um átomo de O |
Produto |
|
C + O |
CO |
| 1 átomo de C + 1 átomo de O | 1 molécula de CO |
| 1 massa atômica de C + 1 massa atômica de O | 1 massa molecular CO |
| 12,01 u C + 16,00 u de O | 28,01 u CO |
|
Para 100 átomos de C e 100 átomos de O |
Produto |
|
C + O |
CO |
| 100 átomos de C + 100 átomos de O | 100 molécula de CO |
| 100 massa atômica de d C + 100 massa atômica de O | 100 massa molecular CO |
| 1201 u C + 1600 u de O | 2801 u CO |
Estes números de átomos ainda é muito pequeno comparado com a quantidade de átomo envolvido em reações químicas em um laboratório. Poderíamos considerar por exemplo as reações envolvendo 6,022 x 1023 átomos de carbono e mesma quantidade de oxigênio para produzir moléculas de CO. Mas, por que estamos escolhendo este número tão grande ? Estamos fazendo isto porque 6,022 x 1023 u é igual a 1,0 grama. Assim,
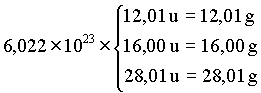
Então para a reação
C + O ® CO
12,01 g de carbono reage com 16,00 g de oxigênio para dar 28,01 g de monóxido de carbono. Em outras palavras, podemos escrever
12,01g de C + 16,00g de O ® 28,01g de CO
Então 6,022 x 1023 é o número de átomos em 12,01 g de carbono, ou o número de átomos em 16,00 g de oxigênio ou o número de moléculas em 28,91 g de monóxido de carbono. Usando a relação
1 g = 6,022 x 1023
podemos expressar a unidade de massa atômica em gramas:
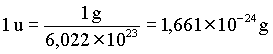
Por esta definição, qualquer quantidade de matéria que contenha 6,022 x 1023 entidades é um mol. Assim, pode-se ter 1 mol de átomos, de moléculas, de íons, de prótons, de elétrons, ou de outras partículas, etc. Havendo tantas possibilidades, a entidade em questão deve ser sempre claramente especificada.
O número 6,022 x 1023 é conhecido por
número de Avogadro em homenagem ao físico italiano Amedeo Avogadro (1776-1856),
que fez uma contribuição muito importante às leis que regulam o comportamento
dos gases. O número de Avogadro, aproximado para três algarismo estabelece que
em 1atg (átomo grama) de um dado elemento químico existem
6,022 x 1023 átomos desse elemento. Isto
significa que;
| 1 atg de cromo (52,0 g) contém 6,022 x 1023 átomos de cromo |
| 1 atg de alumínio (27,0 g) contém 6,022 x 1023 átomos de alumínio |
![]() 12-
Determinação da Massa Molar
12-
Determinação da Massa Molar
Podemos usar a lei do gás ideal para encontrar o número de mols de um gás se conhecemos P, V e T. Se conhecemos a massa de um gás, podemos calcular a sua massa molar. A massa molar, M, é definida por
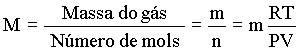
Assim, podemos deduzir a massa molar, M, de um gás (com massa m) conhecendo P, V e T. A seguir damos um procedimento simples para se calcular a massa molar;
![]() - Pese um recipiente,
evacuado e de volume conhecido
- Pese um recipiente,
evacuado e de volume conhecido
![]() - Encha-o, à temperatura
e pressão conhecida, com o gás cuja massa molar será
calculada
- Encha-o, à temperatura
e pressão conhecida, com o gás cuja massa molar será
calculada
![]() - Pese o recipiente,
contendo o gás, novamente
- Pese o recipiente,
contendo o gás, novamente
![]() - Calcule o aumento efetivo
da massa do recipiente
- Calcule o aumento efetivo
da massa do recipiente
![]() - Use a relação
acima para calcular a massa molar.
- Use a relação
acima para calcular a massa molar.
![]() 13- Densidade de um Gás
13- Densidade de um Gás
Vimos anteriormente, que a determinação da massa molar de uma substância gasosa depende do valor da massa do gás que ocupa um recipiente com temperatura, pressão e volume conhecidos. Desde que a densidade é igual a massa/volume, ou d = massa/volume, podemos calcular a massa molar via a sua densidade, isto é
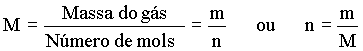
Usando a lei do gás ideal temos que
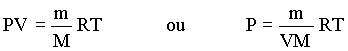
Desde que
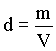
obtemos que

Usando esta equação podemos calcular a massa molecular
de uma substância gasosa em função de sua densidade
à uma dada temperatura e pressão.
![]() 14- Volume Molar de um Gás : Lei de Avogadro
14- Volume Molar de um Gás : Lei de Avogadro
Se nós escrevemos a equação do gás ideal na forma
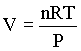
vemos que, para pressão e temperatura constante, um dado número de mols de qualquer gás tem sempre o mesmo valor. Em outras palavras, podemos dizer que
O volume de uma dada quantidade de gás é proporcional ao seu número de mols, estando o gás à temperatura e pressão constante.
![]()
Este resultado é conhecido como lei de Avogadro. Como conseqüência desta lei, tiramos que o volume de 1 mol de um gás ideal à temperatura e pressão constante é igual a
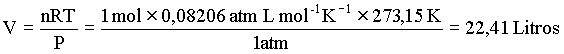
O volume de 1 mol de uma substância é chamado de volume
molar.
![]() Voltar
à página principal
Voltar
à página principal
![]() Voltar ao início desta página
Voltar ao início desta página
![]()
O conteúdo desta página
está em constante atualização.
Correções no texto e sugestões
serão bem vindas.
![]() Electronic
Address :
kcmundim@unb.br
Electronic
Address :
kcmundim@unb.br
Last Updated: Out/22/2000
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura
phone: 55 61 3307 2150