(a)
(b)
Fig. 8 - Representação eletrônica no modelo VSEPR
Aula 10
Estrutura de Átomos e
Moléculas: Modelo VSEPR
- Formas Molecular e o Modelo VSEPR
As moléculas
têm
uma fascinante variedade de formas estruturais. Algumas são
longas,
outras finas, algumas são torcidas e outras planas, algumas
formam
anéis e outras espirais. Nós já mencionamos
vários
tipos e formas de moléculas simples. A água é uma
molécula angular, a amônia é piramidal e o metano
tem
uma tetraédrica. Grandes moléculas tem formas mais
complexas
do que as pequenas. Abaixo mostramos alguns sistemas moleculares
simples
e complexos,
|
|
|
|
|
|
Fig. 7 - Diferentes tipos de estruturas moleculares
Use o mouse para movimentar as moléculas
Contudo, veremos que independente de quão complexa a molécula é, o arranjo geométrico das ligações covalentes em torno de um átomo particular pode ser facilmente deduzido com base em um princípio bastante simples.
Ligações
iônicas
são não direcionais. Um ion atrai para si quantos
íons
de cargas opostas quanto ele pode agrupar em torno de si. Vimos que a
estrutura
de um cristal iônico, como o cloreto de sódio (NaCl),
depende
das cargas e dimensão dos ions o cristal é composto.
Contariamente,
as ligações covalentes são direcionais; um
átomo
forma ligação covalente em uma direção
específica.
A geometria molecular, que é a organização
espacial
dos átomos nas moléculas e nos cristais covalentemente
ligados,
depende da direção ligação covalente
formada
por cada átomo. Um modelo simples que é baseado na
estrutura
de Lewis permite-nos predizer a direção das
ligações
em torno de qualquer átomo em uma molécula. A seguir
vamos
introduzir este modelo aqui. Em química e física ele de
importância
indiscutível.
- O Modelo VSEPR (Valence Shell Electron Pair Repulsion)
De acordo com o modelo VSEPR o par de elétron em uma camada de valência é organizado de forma que cada elétron se posicionará o mais longe possível do seu vizinho, isto ocorre devido a repulsão eletrostática entre eles. Vimos anteriormente que muitos átomos têm oito elétrons ou quatro pares na camada de valência. Em outras palavras eles obedecem a regra do octeto. O arranjo de quatro pares eletrônico é de forma tal a mantê-los o mais afastado uns dos outros, e isto se dá quando os pares eletrônicos estão localizados nos vértices de um tetraedro (fig. 8)
(a)
(b)
Fig. 8 - Representação eletrônica no modelo VSEPR
Os átomos que não obedecem a lei do octeto podem ter somente dois ou três pares de elétrons em sua camada de valência e eles têm um arranjo espacial linear ou triangular, respectivamente, como mostra a fig. 8.
Com base nestas possíveis organizações dos
pares
eletrônicos, podemos predizer a forma de número muito
grande
de moléculas diferentes. Apresentamos na tabela (5) algumas
dessas
organizações moleculares.
|
|
|
|
|
|
Lewis |
|
|
|
|
|
|
|
|
|
BeCl2 |
|
| 3 |
Triangular equilateral |
0 |
|
|
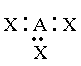 |
AlCl3 |
|
| 1 |
|
|
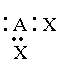 |
|
|
||
| 4 |
Tetraédrica |
0 |
|
|
 |
NH4+ CCl4 |
|
| 1 |
|
|
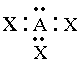 |
NF3 |
|
||
|
|
|
|
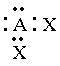 |
F2O |
|
||
|
|
|
|
|
HCl |
Tab. 5
Veja algumas estruturas
moleculares
em 3-dimensões. Use o lado esquerdo do "mouse" para move-la. Use
o lado direito do "mouse" para mudar forma de
visualização
molecular.
|
|
|
|
|
|
Fig. 9 - Diferentes formas moleculares.
Vimos anteriormente que um composto tem uma composição atômica constante, isto é, o número relativo de cada espécie de átomo é constante em um composto. Uma outra característica da composição dos átomos é a forma com que estes átomos estão organizados espacialmente uns com relação aos outros. Esta organização dos átomos em um composto ou elementos é conhecida como a estrutura do composto. Como a estrutura do composto pode produzir muitos efeitos distintos nas propriedades das substâncias, foi necessário criar áreas específicas na química moderna para tratar dos fenômenos relacionados com a estrutura dos compostos. Por exemplo o carbono pode se organizar espacialmente em diferentes formas como no diamante e no grafite.
Antigamente os
químicos não tinham métodos diretos para a
determinação das estruturas dos compostos. A
análise era feita por métodos indiretos, como por exemplo
estudando as propriedades das reações químicas.
Somente nestes últimos sessenta anos é que foram
desenvolvidas novas técnicas experimentais e modelos
teóricos para a determinação e compreensão
das estruturas. A maioria das técnicas experimentais são
baseadas nas interações moleculares com as
radiações eletromagnéticas, tal como o raio-X e a
radiação infravermelha.
Os experimentos e modelos
teóricos têm mostrados que em muitas substâncias os
átomos se combinam formando pequenas estruturas bem definidas.
Estas estruturas são denominadas por moléculas.
A água, por exemplo, consiste de moléculas cuja estrutura
é composta por átomos de hidrogênio e
oxigênio espacialmente organizados. A molécula de
água tem a fórmula H2O, a qual é
chamada de fórmula molecular, a
qual mostra o número de cada espécie de átomos
pertencentes à estrutura molecular. Isto significa que á
molécula de água é composta de dois
hidrogênios e um oxigênio.
Alguns elementos se
apresentam na forma molecular, como por exemplo o oxigênio, o
hidrogênio e o nitrogênio. Isto significa que estas
moléculas são formadas por uma única
espécie de átomo com as respectivas fórmulas
químicas : O2, H2 e N2.
Moléculas tais como O2, H2, N2
e CO, são formadas por apenas dois átomos e são
conhecidas como moléculas diatômicas. Outras
moléculas tais como H2O e CO2 são
moléculas triatômicas. Em geral as moléculas
têm mais de três átomos e são classificadas
como moléculas poliatômicas. As proteínas, por
exemplo, chegam a ter milhares átomos de diferentes
espécies.
|
diatômicas |
|
|
|
|
triatômicas |
|
|
|
|
poliatômicas |
|
|
|
Diferentes tipos de moléculas
Nem todas as substâncias são formadas e compostas por moléculas. Por exemplo o composto NaCl ou cloreto de sódio e o dióxido de silício não têm uma estrutura molecular, como discutido acima. Estes e outros compostos formam estruturas e arranjos tridimensionais de átomos que formam as classes dos cristais por exemplo. Voltaremos a discutir este caso mais tarde. No momento restringiremos nossas atenções às substâncias que consistem de moléculas.
![]() - Fórmulas Empíricas e Moleculares
- Fórmulas Empíricas e Moleculares
As fórmulas moleculares de uma substância não são sempre idênticas com a sua fórmula mínima, a qual expressa o número relativo de átomos de cada espécie contida na substância. Desde que o elemento consiste de uma única espécie de átomo, a fórmula simples para cada elemento é o próprio símbolo do elemento atômico : O para o oxigênio, N para o nitrogênio e P para o fósforo. Por outro lado, as fórmulas moleculares destas substâncias são respectivamente O2, N2 e P4.
A composição do etano, o qual é um gás natural, é expresso pela fórmula CH3. Isto é, para cada carbono tem-se 3 hidrogênios, cuja molécula tem a fórmula química C2H6. Outro exemplo, que podemos citar, é o peróxido de hidrogênio que é um composto de igual número de hidrogênio e oxigênio, cuja composição é representada pela fórmula mínima OH. Contudo, cada molécula de peróxido de hidrogênio contém dois átomos de hidrogênio e dois átomos de oxigênio, cuja fórmula molecular é igual a H2O2.
A fórmula mínima que expressa corretamente a composição da substância, em termos das razões de números inteiros de cada espécie de átomo, é chamada ambém de fórmula empírica. Então as fórmulas empíricas para a água, o peróxido de hidrogênio, o etano, o enxofre e o fósforo são respectivamente: H2O, HO, CH3, S e P. Desde que não se pode ter a participação fracional de átomos em uma molécula, as fórmulas empíricas são escritas como relações de números inteiros dos átomos que compõem a molécula. As fórmulas empíricas da água e do etano são, portanto, escritas como H2O e CH3 e não HO1/2 e C1/3H.
A fórmula molecular de uma substância diz-nos quantos átomos de cada espécie existem em uma molécula de uma substância. Neste sentido, a fórmula molecular da água, do peróxido de hidrogênio, do etano, do enxofre e do fósforo são respectivamente; H2O, H2O2, C2H6, S8 e P4. Notamos assim, que para algumas substâncias as fórmulas empírica e molecular são idênticas, como por exemplo a água H2O. Muitas moléculas, na natureza, em especial aquelas encontradas nos organismos vivos têm estruturas muito complexas quando comparadas com as moléculas acima citadas. Como por exemplo a vitamina E tem a seguinte fórmula molecular C29H50O2, veja figura abaixo.
![]() - Formas e Estrutura Moleculares
- Formas e Estrutura Moleculares
Nós podemos obter
informações sobre a estrutura de uma molécula em
diferentes níveis. Conhecendo-se a fórmula molecular de
uma substância temos como próximo passo responder a
questão: Como os átomos pertencentes a molécula
estão ligados ou conectados? Para dar um exemplo simples tomemos
a molécula de água. Neste caso sabemos que o átomo
de oxigênio está entre os dois átomos de
hidrogênio, isto é HOH e não HHO. Muitos anos
atrás os químicos desenhavam uma linha entre os
átomos como ![]() , pois achavam que os átomos estavam
ligados uns aos outros desta forma. Isto é chamado de fórmula estrutural e as linhas
são chamadas de ligações. A fórmula
estrutural da sacarose, por exemplo, é mostrada na Fig.(2.1a).
Voltaremos a discutir em capítulos posteriores mais
detalhadamente sobre o conceito de ligações
químicas.
, pois achavam que os átomos estavam
ligados uns aos outros desta forma. Isto é chamado de fórmula estrutural e as linhas
são chamadas de ligações. A fórmula
estrutural da sacarose, por exemplo, é mostrada na Fig.(2.1a).
Voltaremos a discutir em capítulos posteriores mais
detalhadamente sobre o conceito de ligações
químicas.
|
|
|
Fig. 2.1 - Fórmula estrutural e estrutura tri-dimensional da Sacarose
A tabela abaixo apresenta um resumo sobre as propriedades
estruturais discutidas acima.
|
Formas e Estruturas Moleculares |
|||
|
Fórmula ou |
Exemplos |
Detalhes |
|
| Fórmula Empírica |
HO |
CH3 |
Número relativo de átomos na molécula |
| Fórmula Molecular |
H2O2 |
|
Número de cada espécie de átomos |
Fórmula Estrutural |
|
 |
Conectividade do átomos |
Forma Espacial |
|
|
Arranjo espacial dos átomos na molécula |
|
Dimensões |
|
|
Distâncias e ângulos |
Tabela 2.1
Hoje, contudo, temos várias técnicas tanto experimentais
quanto teóricas para a determinação
tri-dimensional da estrutura quanto de forma molecular, mesmo para os
casos de grandes moléculas tais como proteínas. Em
particular, com estas técnicas podemos calcular, com
altíssima precisão, as distâncias e ângulo
entre os átomos de hidrogênio e oxigênio em uma
molécula de água (Fig. 2.2). Neste caso, encontra-se que
a distância entre H e O é da ordem de 0,97 angstrom =
0,000 000 000 097 metros e o ângulo é igual a 104,5 graus.
Em um capítulo subsequente apresentaremos algumas destas
técnicas de determinação de estruturas
moleculares.
|
|
|
Fig. 2.2 - Molécula de água
A seguir mostraremos as formas e estruturas de algumas moléculas comuns em nosso dia a dia . Uma delas é a amônia que tem uma forma piramidal (Fig. 2.3) cujo ângulo do ápice da pirâmide é igual a 107,8 graus. Já o metano tem uma forma tetrahédrica, como o carbono ocupando o centro da pirâmide e os quatro hidrogênios nos vértices pirâmide (Fig. 2.4).
|
|
|
Fig. 2.3 - Molécula de amônia (NH3)
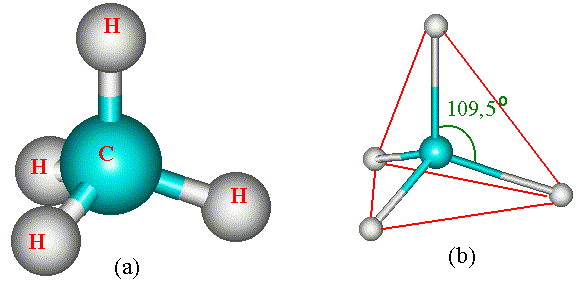
Fig. 2.4 Molécula de metano (CH4)
![]() Electronic
Address :
kcmundim@unb.br
Electronic
Address :
kcmundim@unb.br
Last Updated: Out/22/2000
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura
phone: 55 61 3307 2150